الغاليوم ، الجا ، العدد الذري 31
الغاليوم - سعر الجاليوم ، حدوثه ، استخراجه ، استخدامه
عموما
الغاليوم عنصر فلزي نادر هو عنصر كيميائي نادر الحدوث برمز العنصر Ga والرقم الذري 31. في الجدول الدوري يكون في الفترة الرابعة وهو العنصر الثالث من المجموعة الرئيسية الثالثة (المجموعة 4) أو مجموعة البورون. إنه معدن أبيض فضي يسهل تسييله. لا يتبلور الغاليوم في أحد الهياكل البلورية التي توجد غالبًا في المعادن ، ولكن في تعديله الأكثر استقرارًا في هيكل معيني مع ثنائيات الغاليوم. بالإضافة إلى ذلك ، هناك ستة تعديلات أخرى معروفة والتي تتشكل في ظل ظروف تبلور خاصة أو تحت ضغط مرتفع. من حيث خصائصه الكيميائية ، المعدن مشابه جدًا للألمنيوم.
في الطبيعة ، يوجد الغاليوم إلى حدٍّ ضئيل وغالبًا ما يكون خليطًا في خامات الألمنيوم أو الزنك أو الجرمانيوم ؛ معادن الغاليوم نادرة جدًا. وفقًا لذلك ، يتم الحصول عليها أيضًا كمنتج ثانوي في إنتاج الألومنيوم أو الزنك. تتم معالجة معظم الغاليوم في زرنيخيد الغاليوم أشباه الموصلات ، والذي يستخدم بشكل أساسي في الثنائيات الباعثة للضوء.
ظهور
يعد الغاليوم عنصرًا نادرًا على الأرض ، حيث يحتوي على 19 جزء في المليون في القشرة القارية ، وتضاهي وفرته تلك الموجودة في الليثيوم والرصاص. لا يحدث في شكل عنصري ، ولكن فقط في شكل مرتبط ، بشكل رئيسي في خامات الألمنيوم أو الزنك أو الجرمانيوم. أغنى الخامات في الغاليوم تشمل البوكسيت وخامات الزنك المخلوط والجرانيت.
محتويات الغاليوم منخفضة في الغالب ، والبوكسيت الموجود في سورينام بأعلى محتوى معروف يحتوي فقط على 0,008٪ من الغاليوم. احتياطي الغاليوم في البوكسيت في جميع أنحاء العالم هو 1,6 · 106 تقدر الأطنان. توجد محتويات أعلى من الجاليوم تصل إلى 1٪ في الجرمانيت. فقط في منجم Apex في ولاية يوتا الأمريكية توجد الخامات عالية جدًا لدرجة أنه تمت محاولة استخراج الغاليوم. ومع ذلك ، فشل هذا بعد وقت قصير لأسباب الربحية.
لا يُعرف سوى عدد قليل من معادن الغاليوم ، من بينها الغاليت (CuGaS2) ، Söhngeit (Ga (OH)3) و tsumgallite (GaO (OH)).
استخراج والعرض
يتم الحصول على الغاليوم كمنتج ثانوي في إنتاج الألومنيوم من البوكسيت في عملية باير. يتم استخدام خليط ألومينات الصوديوم وغالات الصوديوم المذابة في هيدروكسيد الصوديوم كمنتج أولي. يمكن فصل الغاليوم عن الألومنيوم باستخدام عمليات مختلفة. أحد الاحتمالات هو التبلور الجزئي بمساعدة ثاني أكسيد الكربون ، مع ترسيب هيدروكسيد الألومنيوم في البداية بشكل تفضيلي بينما يتراكم غاليت الصوديوم الأكثر قابلية للذوبان في محلول هيدروكسيد الصوديوم. يتم ترسيب هيدروكسيد الغاليوم فقط بعد خطوات معالجة أخرى ، مختلطة بهيدروكسيد الألومنيوم. ثم يتم إذابة الخليط في محلول هيدروكسيد الصوديوم ويتم الحصول على الغاليوم عن طريق التحليل الكهربائي. نظرًا لأن هذه العملية كثيفة الاستخدام للطاقة والعمالة ، فهي تُستخدم فقط في البلدان ذات التكلفة المنخفضة ، مثل جمهورية الصين الشعبية.
يمكن أيضًا الحصول على الغاليوم مباشرة من محلول هيدروكسيد الصوديوم عن طريق التحليل الكهربائي. يتم استخدام كاثودات الزئبق لهذا الغرض ، حيث يتم تكوين ملغم الغاليوم أثناء التحليل الكهربائي. من الممكن أيضًا إضافة ملغم الصوديوم إلى المحلول.
بمساعدة هيدروكسي كينولين خاص مثل روابط مخلبية ، من الممكن استخلاص الغاليوم من الصودا الكاوية بالكيروسين وبالتالي فصله عن الألومنيوم. يمكن فصل العناصر الأخرى ، التي يتم استخلاصها أيضًا ، باستخدام الأحماض المخففة. يتم بعد ذلك إذابة مركب الغاليوم المتبقي في حمض الهيدروكلوريك أو حمض الكبريتيك المركز ويختزل كهربائيا إلى المعدن.
الغاليوم النقي مطلوب للعديد من التطبيقات التقنية ؛ لأشباه الموصلات ، على سبيل المثال ، قد تحتوي فقط على مائة مليون من المواد الغريبة. طرق التنظيف الممكنة هي التقطير الفراغي أو التبلور الجزئي أو ذوبان المنطقة.
كمية الغاليوم المنتجة صغيرة ، في عام 2008 كان الإنتاج الأولي العالمي 95 طنًا. مصدر مهم آخر هو إعادة تدوير النفايات المحتوية على الغاليوم ، والتي تم استخراج 2008 طنًا إضافيًا منها في عام 135. الدول المنتجة الرئيسية هي جمهورية الصين الشعبية وألمانيا وكازاخستان وأوكرانيا ، لإعادة تدوير الغاليوم أيضًا الولايات المتحدة واليابان والمملكة المتحدة.
على نطاق معمل ، يمكن إنتاج الغاليوم عن طريق التحليل الكهربائي لمحلول هيدروكسيد الغاليوم في محلول هيدروكسيد الصوديوم على أقطاب كهربائية من البلاتين أو التنجستن.
المواصفات
الخصائص الفيزيائية
الغاليوم معدن أبيض فضي ناعم (صلابة موس: 1,5). لديها نقطة انصهار منخفضة بشكل غير عادي للمعادن ، وهي 29,76 درجة مئوية. بعد الزئبق والسيزيوم ، يكون المعدن ذو أدنى نقطة انصهار ، وهو أيضًا أقل بكثير من عنصر الألمنيوم والإنديوم المجاورين. ربما يرجع ذلك إلى البنية البلورية غير العادية ، والتي ، على عكس هياكل المعادن الأخرى ، لا تتمتع بدرجة عالية من التناظر وبالتالي فهي غير مستقرة للغاية. نظرًا لأن نقطة الغليان مرتفعة نسبيًا عند 2204 درجة مئوية ، فإن الغاليوم يحتوي على مساحة كبيرة بشكل غير عادي يكون فيها سائلًا. نظرًا لصعوبة التبلور ، يمكن بسهولة تبريد الغاليوم السائل تحت نقطة الانصهار (التبريد الفرعي) ويتبلور فجأة عند تشكل نوى التبلور.
مثل السيليكون وبعض العناصر الأخرى والماء ، يحتوي الغاليوم على شذوذ في الكثافة ؛ كثافته في الحالة السائلة أعلى بنحو 3,2٪ من الحالة الصلبة. هذا نموذجي للمواد التي لها روابط جزيئية في الحالة الصلبة.
الغاليوم مغناطيسي في الحالة الصلبة ، لكنه يصبح مغناطيسيًا في الحالة السائلة ( = 2,4 10-6 عند 40 درجة مئوية)
= 2,4 10-6 عند 40 درجة مئوية)
تكوين روابط الغاليوم الغاليوم هو سمة من سمات هياكلها. تُعرف التعديلات المختلفة التي تتشكل في ظل ظروف تبلور مختلفة (أربعة تعديلات معروفة ، α- إلى δ-غاليوم ، تحت الضغط العادي) وتحت الضغط (ما مجموعه ثلاثة تعديلات أخرى للضغط العالي ، Ga-II ، Ga-III ، Ga-IV). التعديل الأكثر ثباتًا في درجة حرارة الغرفة هو α-gallium ، والذي يتبلور في بنية طبقة لتقويم العظام. في كل حالة ، ترتبط ذرتان ببعضهما البعض عبر رابطة تساهمية تشكل ثنائيًا. كل ذرة غاليوم مجاورة أيضًا لست ذرات أخرى من ثنائيات أخرى. توجد روابط معدنية بين الثنائيات الفردية. ثنائيات الغاليوم مستقرة للغاية بحيث يتم الاحتفاظ بها في البداية حتى عندما تذوب ويمكن أيضًا اكتشافها في الطور الغازي.
تحدث تعديلات أخرى أثناء تبلور الغاليوم السائل فائق التبريد. عند درجة حرارة -16,3 درجة مئوية ، تتشكل β-Gallium ، والتي لها بنية بلورية أحادية الميل. يوجد في الهيكل سلاسل متعرجة متوازية من ذرات الغاليوم. في حالة حدوث التبلور عند درجة حرارة 19,4 درجة مئوية ، يتم تكوين ثلاثي الزوايا δ-غاليوم ، حيث يوجد ، على غرار α-boron ، هناك مشوهة مشوهة مكونة من اثني عشر ذرة غاليوم. هذه مرتبطة ببعضها البعض عبر ذرات الغاليوم الفردية. عند درجة حرارة -35,6 درجة مئوية ، يتشكل البيت-الغاليوم أخيرًا. في هذا التعديل لتقويم العظام ، يتم تشكيل الأنابيب من Ga المترابطة7حلقات في منتصف سلسلة خطية من ذرات الغاليوم الأخرى.
إذا تم وضع الغاليوم تحت ضغط مرتفع في درجة حرارة الغرفة ، يتم تشكيل تعديلات مختلفة للضغط العالي واحدة تلو الأخرى عند زيادة الضغط. تعديل مكعب الغاليوم -30 مستقر فوق 140 كيلو بار ، حيث تُحاط كل ذرة بثمانية أخرى. إذا زاد الضغط إلى 1200 كيلو بار ، يتبلور المعدن الآن على شكل رباعي الزوايا الغاليوم الثالث في هيكل يتوافق مع هيكل الإنديوم. إذا زاد الضغط أكثر إلى حوالي XNUMX كيلو بار ، يتم أخيرًا تكوين الهيكل المكعب المتمركز على الوجه من الغاليوم IV.
الخواص الكيميائية
الخصائص الكيميائية للغاليوم مماثلة لتلك الخاصة بالألمنيوم. مثل هذا ، يتم تخميل الغاليوم عن طريق تكوين طبقة أكسيد كثيفة في الهواء ولا يتفاعل. فقط في الأكسجين النقي عند الضغط العالي يحترق المعدن بلهب ساطع لتكوين الأكسيد. وبالمثل ، فإنه لا يتفاعل مع الماء أيضًا ، حيث يتكون هنا هيدروكسيد الغاليوم غير القابل للذوبان. من ناحية أخرى ، إذا كان الغاليوم مخلوطًا بالألمنيوم وكان سائلًا في درجة حرارة الغرفة بسبب انخفاض نقطة الانصهار ، فإنه يتفاعل بعنف مع الماء. يتفاعل الغاليوم أيضًا بسرعة مع الهالوجينات لتكوين الأملاح المقابلة GaX3.
الغاليوم مذبذب وقابل للذوبان في كل من الأحماض والقواعد مع تطور الهيدروجين. في الأحماض ، مثل الألومنيوم ، تتشكل الأملاح مع Ga3+الأيونات ، في قواعد جالاتيس من النموذج [Ga (OH)4]-. يذوب ببطء في الأحماض المخففة وبسرعة في أكوا ريجيا والصودا الكاوية المركزة. يتم تخميل الغاليوم بحمض النيتريك.
![\ mathrm {2 \ NaOH + 2 \ Ga + 6 \ H_2O \ rightarrow 2 \ Na [Ga (OH) _4] + 3 \ H_2 \ uparrow}](https://upload.wikimedia.org/wikipedia/de/math/7/e/6/7e633a1c6ed8f76b3ebfabbcaba5e544.png)
- تفاعل الغاليوم مع الصودا الكاوية
تتعرض معظم المعادن للهجوم بواسطة الغاليوم السائل ، لذلك لا يمكن تخزينها إلا في حاويات مصنوعة من الكوارتز والزجاج والجرافيت وأكسيد الألومنيوم والتنغستن حتى 800 درجة مئوية والتنتالوم حتى 450 درجة مئوية.
النظائر
يوجد إجمالي 30 نظيرًا من نظائر الغاليوم بينهما 56جا و 86Ga وسبعة ايزومرات أساسية أخرى معروفة. من هؤلاء اثنان 69جا و 71الجا مستقرة وتحدث أيضا في الطبيعة. في التركيب النظري الطبيعي يغلب 69Ga مع 60,12٪ ، 39,88٪ هي 71من النظائر غير المستقرة 67Ga مع 3,26 يومًا ، أطول نصف عمر ، وتتراوح فترات نصف العمر الأخرى من ثوانٍ إلى 14,1 ساعة كحد أقصى 72الجا.
اثنين من نظائر الغاليوم ، 67Ga والواحد قصير العمر بعمر نصف 67,71 دقيقة 68تستخدم الجا في الطب النووي كمقتفعات للتصوير المقطعي بالإصدار البوزيتروني. 67يتم إنتاج Ga في سيكلوترون ، أثناء إنتاج 68ليست هناك حاجة إلى السيكلوترون. بدلاً من ذلك ، فإن نظير الجرمانيوم طويل العمر 68قه من خلال تشعيع 69ولدت Ga مع البروتونات. هذا ينهار 68جا ، الناتجة 68يمكن استخلاص Ga في مولد غاليوم 68. بالنسبة للدراسات ، عادة ما يكون الغاليوم مرتبطًا في مجمع به يجند مخلب بقوة مثل 1,4,7,10،1,4,7,10،XNUMX،XNUMX-tetraazacyclodecane-XNUMX،XNUMX،XNUMX،XNUMX-tetraacetic acid (DOTA).
استعمال
نظرًا لندرة العنصر ، لا يستخدم الغاليوم إلا في نطاق محدود. يتم تصنيع مركبات الغاليوم المختلفة من معظم الغاليوم المنتج. أهمها من الناحية الاقتصادية حتى الآن تلك التي تحتوي على عناصر من المجموعة الخامسة الرئيسية ، فوق كل زرنيخيد الغاليوم ، المطلوب للخلايا الشمسية والصمامات الثنائية الباعثة للضوء ، من بين أشياء أخرى. في عام 5 ، تم استخدام 2003 ٪ من الغاليوم المنتج لهذا الغرض. كما أنه يستخدم كمواد لتعاطي المنشطات بالسيليكون (المنشطات p).
يتم استخدام نطاق درجة الحرارة الكبير الذي يكون فيه العنصر سائلًا وضغط البخار المنخفض في نفس الوقت لبناء موازين الحرارة. يمكن استخدام موازين حرارة الغاليوم حتى درجات حرارة تصل إلى 1200 درجة مئوية. يمكن استخدام الغاليوم السائل كسائل حاجز لقياس حجم الغازات عند درجات حرارة أعلى وكمواد قطب كهربي سائل في استخلاص المعادن فائقة النقاء مثل الإنديوم.
يتمتع الغاليوم بقدرة عالية على التبلل وانعكاس جيد ، وبالتالي يستخدم كطلاء للمرايا. كما أنه يستخدم في السبائك المنصهرة ، وللمبادلات الحرارية في المفاعلات النووية وكبديل للزئبق في المصابيح.
لسبائك الغاليوم مع معادن أخرى استخدامات مختلفة. يتم إنشاء المواد المغناطيسية عن طريق الخلط مع الجادولينيوم والحديد والإيتريوم والليثيوم والمغنيسيوم. سبيكة مع الفاناديوم في تكوين V3الجا هو موصل فائق بدرجة حرارة انتقال عالية نسبيًا تبلغ 16,8 كلفن في الأسلحة النووية ، وهو مخلوط بالبلوتونيوم لمنع تغيرات الطور. العديد من سبائك الغاليوم مثل Galinstan تكون سائلة في درجة حرارة الغرفة ويمكن أن تحل محل الزئبق السام أو سبائك الصوديوم والبوتاسيوم شديدة التفاعل.
دليل
يمكن الكشف عن الغاليوم نوعيًا من خلال تفاعلات ألوان نموذجية مختلفة. وتشمل هذه التفاعلات مع رودامين ب في البنزين ، الذي يتألق باللون البرتقالي والأصفر إلى البنفسجي الأحمر عند إضافة الغاليوم ، والمورين ، الذي يظهر التألق الأخضر كما هو الحال في التفاعل مع الألومنيوم ، وسداسي أانيدوفيرات البوتاسيوم (III) ، مع الغاليوم ، وهو راسب أبيض من هيكسايسانيدوفيرات الغاليوم (III) ) نماذج. علاوة على ذلك ، يمكن الكشف عن التحليل الطيفي عبر الخطوط الطيفية البنفسجية المميزة عند 417,1 و 403,1 نانومتر.
يمكن تقديم الدليل الكمي عن طريق المعايرة المعقدة ، على سبيل المثال مع حمض إيثيلين ديامينيتتراسيتيك أو عن طريق مطياف الامتصاص الذري.
علم السموم والأهمية البيولوجية
لا توجد بيانات سمية لمعدن الغاليوم ؛ ومع ذلك ، فهو مادة أكالة للجلد والأغشية المخاطية. مركبات الجاليوم (III) نترات Ga (NO3)3 وأكسيد الغاليوم (III) Ga2O3 تمتلك LD عن طريق الفم50القيم في نطاق الجرام: 4,360 جم / كجم للنترات و 10 جم / كجم للأكسيد. لذلك يعتبر الغاليوم منخفض السمية ، وبقدر ما هو معروف ، لا يلعب أي دور في البشر كعنصر ضئيل.
روابط
في المركبات ، يوجد الغاليوم بشكل حصري تقريبًا في حالة الأكسدة +3. بالإضافة إلى ذلك ، تُعرف مركبات الغاليوم (I) النادرة وغير المستقرة جدًا عادةً وكذلك تلك التي تحتوي على كل من مركبات الغاليوم أحادية التكافؤ (مركبات الغاليوم (II)).
المركبات مع عناصر مجموعة النيتروجين
أهم مركبات الغاليوم من الناحية الفنية هي تلك التي تحتوي على عناصر مجموعة النيتروجين. نيتريد الغاليوم ، فوسفيد الغاليوم ، زرنيخيد الغاليوم ، أنتيمونيد الغاليوم هي أشباه موصلات نموذجية (أشباه الموصلات III-V) وتستخدم للترانزستورات والثنائيات والمكونات الأخرى في الإلكترونيات. على وجه الخصوص ، يتم إنتاج الثنائيات الباعثة للضوء بألوان مختلفة كمركبات من مجموعات الغاليوم والنيتروجين. يمكن تعديل اللون ، الذي يعتمد على فجوة النطاق ، حسب النسبة المختلفة للأنيونات أو عن طريق استبدال الغاليوم بالألمنيوم أو الإنديوم. يستخدم زرنيخيد الغاليوم أيضًا للخلايا الشمسية. تستخدم هذه في الأقمار الصناعية على وجه الخصوص ، لأن زرنيخيد الغاليوم أكثر مقاومة للإشعاع المؤين من السيليكون.
هاليدات
هاليدات الغاليوم للشكل GaX3 تتشابه في العديد من الخصائص مع مركبات الألمنيوم المقابلة. باستثناء فلوريد الغاليوم (III) ، فإنها تحدث على شكل ثنائيات في هيكل بروميد الألومنيوم. كلوريد الغاليوم (III) هو هاليد وحيد ذو أهمية اقتصادية قليلة. يتم استخدامه كحمض لويس في تفاعلات فريدل كرافتس.
اتصالات أخرى
مثل أكسيد الألومنيوم ، أكسيد الغاليوم (III) هو مادة صلبة عديمة اللون وذوبان عالية. يحدث في خمسة تعديلات مختلفة ، تعديل مكعب هو الأكثر استقرارًا.
توجد مركبات الغاليوم العضوية مثل Gallane GAR3, Gallylene GAR وكما غالون أعلىالتي تحتوي على روابط الغاليوم الغاليوم. مثل العديد من المركبات العضوية المعدنية الأخرى ، فهي غير مستقرة للهواء والتحلل المائي. أحد مركبات الغاليوم العضوية القليلة ذات الأهمية الاقتصادية هو ثلاثي ميثيل الجاليوم ، والذي يستخدم ككاشف منشط ولإنتاج طبقات رقيقة من زرنيخيد الغاليوم ونتريد الغاليوم في حالة تداخل الغاز العضوي المعدني.
| عموما | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| الاسم والرمز والرقم الذري | الغاليوم ، الجا ، 31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| سلسلة | المعادن | ||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة ، الفترة ، الكتلة | 13 ، 4 ، ص | ||||||||||||||||||||||||||||||||||||||||||||||||
| مظهر | أبيض فضي | ||||||||||||||||||||||||||||||||||||||||||||||||
| عدد CAS | 7440-55-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| جزء من كتلة الأرض قذيفة | 14 جزء في المليون | ||||||||||||||||||||||||||||||||||||||||||||||||
| نووي | |||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 69,723 ش | ||||||||||||||||||||||||||||||||||||||||||||||||
| نصف القطر الذري (محسوب) | 130 (136) مساءً | ||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر التساهمية | 122 PM | ||||||||||||||||||||||||||||||||||||||||||||||||
| فان دير فال دائرة نصف قطرها | 187 PM | ||||||||||||||||||||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | [ع] 3d10 4s2 4p1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. التأين | 578,8 كيلو جول / مول | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. التأين | 1979,3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. التأين | 2963 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| بدنيا | |||||||||||||||||||||||||||||||||||||||||||||||||
| الحالة الفيزيائية | مهرجان | ||||||||||||||||||||||||||||||||||||||||||||||||
| التعديلات | سبعة | ||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة | شنومكس ز / سم3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| صلابة موس | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| مغنطيسية | مغناطيسي ( = -2,3 10-5) = -2,3 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| درجة الإنصهار | 302,91 كلفن (29,76 درجة مئوية) | ||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 2477 كلفن (2204 درجة مئوية) | ||||||||||||||||||||||||||||||||||||||||||||||||
| حجم المولي | 11,80 · 10-6 m3/ مول | ||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 256 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 5,59 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت | 2740 م / ث في 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| قدرة حرارة محددة | 371 جول / (كجم · ك) | ||||||||||||||||||||||||||||||||||||||||||||||||
| الموصلية الكهربائية | حول 7,14 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||
| توصيل حراري | 29 واط / (م · ك) | ||||||||||||||||||||||||||||||||||||||||||||||||
| كيميائي | |||||||||||||||||||||||||||||||||||||||||||||||||
| التأكسد | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| إمكانات طبيعية | −0,53 فولت (Ga3+ + 3 هـ- → Ga) | ||||||||||||||||||||||||||||||||||||||||||||||||
| الكهربية | 1,81 (مقياس بولينج) | ||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| سلامة | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
 |
أسعار الغاليوم ، الرسوم البيانية ، السعر
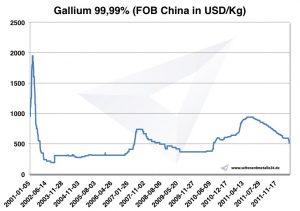
الرسم البياني Gallium 2001-2011
أسعار الغاليوم -> أسعار الغاليوم بأسعار المعادن الاستراتيجية
