السيليكون ، سي ، العدد الذري 14
سعر السيليكون ، حدوث ، استخراج واستخدام
يعتبر السيليكون ، أيضًا السيليكون ، عنصرًا كيميائيًا يحتوي على الرمز Si والرقم الذري 14. إنه في 4. المجموعة الرئيسية (مجموعة الكربون) ، أو 14. مجموعة IUPAC و 3. فترة الجدول الدوري للعناصر. من حيث الكسر الجماعي (ppmw) ، فهو ثاني أكثر العناصر وفرة في قشرة الأرض بعد الأكسجين.
السيليكون عبارة عن شبه معدن كلاسيكي ، وبالتالي له خصائص المعادن وغير المعدنية ، وهو أشباه الموصلات عنصري. يحتوي السيليكون النقي النقي على اللون الرمادي والأسود وله معدني عادة ، وغالبًا ما يكون من البرونز إلى اللمعان المزرق.
يعتبر السيليكون أمرًا مهمًا للغاية بالنسبة للإلكترونيات ، نظرًا لأن 2018 في شكل نقي النظير يخدم أيضًا في تحديد كيلوغرام. السيليكون الأولي غير سام لجسم الإنسان ، والسيليكون في شكل سيليكات منضم مهم للبشر. يحتوي جسم الإنسان على حوالي 20 mg / kg من كتلة الجسم من السيليكون ؛ ينخفض المبلغ مع تقدم العمر.
هجاء وعلم أصول الكلام
بشكل افتراضي ، يتم كتابة العنصر 'silicon'. تدوين مع ، ج 'يستخدم أساسا في المصطلحات الكيميائية. كلا الهجاء ينبعان من المصطلح اللاتيني silicia ، السيليكا ، المرتبط باللاتينية silex 'pebble' ، 'rock'.
الكلمة الإنجليزية للسيليكون هي السيليكون. يتم تضمينه ، على سبيل المثال ، في اسم وادي السيليكون. تعتبر ترجمة السيليكون التي تتم مواجهتها من حين لآخر صديقًا خاطئًا ، لأن السيليكونات هي فئة من المركبات الكيميائية للسيليكون.
قصة
استخدامها في أوقات ما قبل الصناعية
لعبت مركبات السيليكون ، وخاصة الصخور ، دورًا مهمًا في تاريخ البشرية كمواد بناء. مثال نموذجي لبنية الحجر في وقت مبكر هو ستونهنج. من المواد السيليسية المهمة الأخرى التي تم استخدامها كمواد بناء لفترة طويلة هي الطميية ، والتي كانت مبدئية تستخدم في بناء الطين من الألياف الفرعية ، في وقت لاحق في شكل قرميد. تم تطوير الأسمنت ، الذي يحتوي أيضًا على سيليكات ، من قبل الرومان.
بسبب حوافها الحادة ، استخدمت الصخور السيليسية أيضًا كأدوات في العصر الحجري. كان حجر السج ، على سبيل المثال ، قد تم استخراجه بالفعل كمواد أداة مناسبة بشكل خاص في فترة ما قبل التاريخ ووزعت على نطاق واسع عن طريق التجارة. تم استخراج فويرشتاين في مناطق الطباشير ، مثل بلجيكا والدنمارك. في استخراج المعادن ، وخاصة في صناعة الصلب ، يتم استخدام خبث السيليكات لحماية المواقد والأفران من دخول الأكسجين وكقوالب طينية أو رملية ؛ ربما تم اكتشاف صناعة الزجاج.
اكتشاف كعنصر
لأول مرة في العام ، توقع 1789 Antoine Lavoisier أن Silex هو أكسيد الفلز. في عام 1807 ، افترض همفري ديفي اختبارات كهروكيميائية لوجود معادن السيليكون والألومنيوم والزركونيوم والجلوكينيوم (البريليوم).
"لو كنت محظوظًا للغاية للحصول على هذا الموضوع ، ولكني اشتريت المواد المعدنية التي كنت أبحث عنها ، كان ينبغي أن أقترح أسماء السيليسيوم والألوميوم والزركونيوم والجلوكيوم".
"إذا كنت سعيدًا للغاية للحصول على أدلة أكثر موثوقية حول هذا الموضوع وعلمت المواد المعدنية التي بحثت عنها ، لكنت قد اقترحت عليهم أسماء السيليكون والألوميوم والزركونيوم والغلوكسيوم."
- همفري ديفي
في 1811 ، أنتج الكيميائي جوزيف لويس جاي-لوساك ولويس جاك تينارد (انظر ثيناردز بلاو) السيليكون غير النقي وغير المتبلور (أ-سي ، الشكل غير البلوري ، من السيليكون المتآثر). للقيام بذلك ، تفاعلوا مع رباعي فلوريد السيليكون بالبوتاسيوم الأولي. تبع إجراء مماثل Xnumx بواسطة Jöns Jakob Berzelius في السويد بتفاعل سداسي فلورو سليكات مع البوتاسيوم الأولي. Berzelius تنظيف الناتجة غير متبلور السيليكون عن طريق الغسيل. لقد كان أول من عرف الطبيعة الأولية للسيلكون وأعطاها اسمه.
مشتق من مصطلح السيليكون silex الكلمة اللاتينية (حصاة ، فلينت). وهو يعبر عن أن السيليكون أكثر شيوعًا في العديد من المعادن.
اقترح المصطلح الإنجليزي للسيليكون على 1817 من قبل الكيميائي الاسكتلندي توماس طومسون (1773-1852). والغرض من النهاية هو الإشارة إلى العلاقة الكيميائية بالكربون غير المعدني (الكربون) والبورون (البورون).
أول إنتاج للسيليكون النقي البلوري في العام 1854 نجح في الكيميائي الفرنسي هنري إتيان سانت كلير ديفيل عن طريق التحليل الكهربائي.
ظهور
الأرض كلها حول 15 في المئة من كتلة السيليكون. على وجه الخصوص ، يتكون الوشاح إلى حد كبير من ذوبان صخور السيليكات. تبلغ قشرة الأرض حوالي 25,8 من وزن السيليكون. هذا يجعله ثاني أكثر العناصر الكيميائية وفرة بعد الأكسجين. هنا ، يحدث السيليكون بشكل أساسي في صورة معادن السيليكات أو السيليكا النقية.
لذلك يتكون الرمل أساسا من السيليكا. الكوارتز هو السيليكا النقي. تتكون العديد من الأحجار الكريمة من ثاني أكسيد السيليكون ومضافات أكثر أو أقل من مواد أخرى ، مثل الجمشت ، الورد والدخان الكوارتز ، العقيق ، اليشب والأوبال. يشكل السيليكون السيليكات مع العديد من المعادن. ومن الأمثلة على الصخور السيليسية الميكا والأسبستوس والطين والصخر الزيتي والفلسبار والحجر الرملي. تمثل المحيطات أيضًا خزانًا ضخمًا من السيليكون: في شكل حمض سيليك أحادي ، يتم إذابته بكميات كبيرة في جميع المحيطات. كليًا (اعتبارًا من: 2011) تُعرف معادن 1437 من السيليكون ، حيث يحتوي المويسانيت النادر الذي يحتوي على نسبة تصل إلى 70٪ على أعلى محتوى من السيليكون (للمقارنة: يحتوي الكوارتز المعدني على محتوى من السيليكون يصل إلى 46,7٪).
نظرًا لأن السيليكون يحدث في الطبيعة أيضًا في صورة كريمة ، وهذا شكل أولي ، فقد تم الاعتراف به من قبل الجمعية الدولية للمعادن (IMA) كمعدن وهو في تصنيف Strunz'schen Mineral (إصدار 9) بموجب النظام رقم. قاد 1.CB.15 (طبعة 8: I / B.05-10) في قسم شبه المعادن وغير المعادن. في التصنيف الأكثر شهرة في تصنيف المعادن الناطقة باللغة الإنجليزية وفقًا لـ Dana ، يحمل العنصر المعدني النظام رقم. 01.03.07.01.
تم اكتشاف السيليكون الصلب (2011) في مواقع 15 ، بما في ذلك لأول مرة في مستودع Nuevo Potosí في كوبا. توجد مناطق أخرى في جمهورية الصين الشعبية وروسيا وتركيا والولايات المتحدة.
Silicatkreislauf
تتحلل معادن السيليكات بشكل دائم عن طريق التفاعل مع حمض الكربونيك في الماء لتشكيل حامض ميتاسيليك وكربونات ، كما هو مبين في مثال سيليكات الكالسيوم:
يتفاعل حمض metasilicic غير القابل للذوبان بشكل إضافي مع حمض الكربونيك ليشكل حمض orthosilicic القابل للذوبان:
ومع ذلك ، يتفاعل حمض الأورثوسيليسيك مع نفسه مرة أخرى بسرعة نسبية لتكوين (غير متبلور) ثاني أكسيد السيليكون والماء ، بشرط أن تكون قيمة الرقم الهيدروجيني ≥ 3. التركيز المطلق لحمض الأورثوسيليسيك منخفض نسبيًا (على سبيل المثال <حوالي 7 ملي مول في مياه البحر).
دمج السيليكا أو السيليكات القابلة للذوبان في الماء في الكائنات البحرية (1.) ، أي الرواسب عند الانقراض بعد الغرق ، أو عن طريق التسرب البركاني والصهاريج في قاع البحر تعمل على إعادة المعادن السيليكات (2.) وتغلق الدورة:
الأفق الزمني الذي تحدث فيه هذه العملية هو عدة ملايين من السنين ، لذلك فهي أطول بكثير مما كانت عليه في حالة دورة الكربون في الطبيعة الحية.
السيليكون في الطبيعة الحية
بالإضافة إلى الطبيعة الأساسية التي تم ذكرها بالفعل من السيليكون ، هناك عدد من الكائنات الحية التي تنتج هياكل تحتوي على ثاني أكسيد السيليكون. وأكثرها شهرة هي الدياتومات والإسفنج (Porifera و Spongiaria) والأخصائيون الإشعاعيون ، الذين يشكلون هيكلًا خارجيًا من ثاني أكسيد السيليكون عن طريق التكثيف المحفز بالإنزيم في حمض الأورثوسيليك Si (OH) 4. تحتوي العديد من النباتات أيضًا على السيليكا في سيقانها وأوراقها. الأمثلة المعروفة هنا هي ذيل الحصان ونبات الخيزران. يمنحهم العمود الفقري السيليكا المدمج مزيدًا من الاستقرار.
أهمية فسيولوجية للبشر
يبدو أن هناك حاجة لسليكون العظام والنضج. في العجول ، أدت إدارة أورثوسيليكات إلى انتشار الكولاجين في الجلد والغضاريف. كمية المرغوب فيه المستمدة من التجارب على الحيوانات هي 30 ملغ / د. أوجه القصور في البشر ليست معروفة بعد.
السيليكا أو السيليكا تيرا هي منتجات عن طريق الفم. بشكل أساسي ، تحتوي على أنهيدريد السيليك (ثاني أكسيد السيليكون) ويقال إنها تقوي الجلد والأظافر والعظام والأنسجة الضامة وتحافظ عليها بصحة جيدة. تأثير لم يثبت علميا.
يمكن أن يؤدي وجود فائض من السليكون إلى انحلال كريات الدم الحمراء ، ونتيجة لذلك ، تتغير الخلايا.
استخراج في المختبر
يمكن الحصول على السيليكون الأولي على نطاق المختبر عن طريق الاختزال ، بدءًا من السيليكا أو رباعي فلوريد السيليكون ، مع المعادن الأساسية. Reaction 2.) هي عملية aluminothermic ، والتي تعمل فقط مع إضافة الكبريت الأولي ، والمسار الثالث يتوافق مع اكتشاف العنصر:
يمكن الحصول على السيليكون المتبلور عالي التفاعل عن طريق الاختزال باستخدام تحلل الصوديوم أو الحامض للسيليكات:
استخراج في الصناعة
يستخدم السيليكون الأولي في درجات مختلفة من النقاء في المعادن (السبائك الحديدية) ، الخلايا الضوئية (الخلايا الشمسية) وفي الإلكترونيات الدقيقة (أشباه الموصلات ، ورقائق الكمبيوتر). وفقًا لذلك ، من الشائع في هذه الصناعة تصنيف السيليكون الأولي بناءً على درجات نقاء مختلفة. يتم التمييز بين simg (الصف المعدني ، السيليكون الخام ، نقاء 98-99٪) ، sisg (الصف الشمسي ، السيليكون الشمسي ، الشوائب الأصغر من 0,01٪) والنصر (التقدير الإلكتروني ، سيليكون أشباه الموصلات ، شوائب 10 الصغيرة). بالنسبة للخلايا الشمسية ، تعد نقاوة المادة في جميع أنحاء سمكها مهمة لضمان أطول عمر ممكن للناقل ، وبالنسبة للعديد من التطبيقات في الإلكترونيات الدقيقة ، يجب أن تكون الطبقات العليا من ميكرون 9 إلى 20 نقيًا للغاية.
تقليديا ، يتم استخدام عملية Siemens ، حيث يتم تفاعل السيليكون لأول مرة مع كلوريد الهيدروجين الغازي عند 300-350 ° C في مفاعل طبقة مميعة للترايكلوروسيلان (سيليكوكلوروفورم).
بعد عدة خطوات تقطير ، يتحلل الترايكلوروسيلان حرارياً في وجود الهيدروجين في عكس رد الفعل أعلاه على قضبان السيليكون عالية الحرارة المسخنة في 1000-1200 ° C. السيليكون عنصري ينمو على قضبان. يتم إرجاع كلوريد الهيدروجين المحرّر إلى الدورة الدموية. وكمنتج ثانوي ، يترسب رابع كلوريد السيليكون ، الذي يتم تحويله إما إلى الترايكلوروسيلان ويعاد إلى العملية أو يحترق في لهب الأكسجين إلى سيليكا بروجينية. تنتج عملية Siemens 19 kg من النفايات والمنتجات الثانوية لكل كيلوغرام من السيليكون عالي النقاء.
السيليكون الخام
على المستوى الصناعي ، يتم الحصول على السيليكون الأولي عن طريق تقليل السيليكا مع الكربون في فرن تقليل الصهر عند درجات حرارة حوالي 2000 ° C. المواد الأولية هي رمل الكوارتز أو الكوارتز الحصى.
أنتجت 2002 حوالي 4,1 مليون طن من السيليكون الخام الصناعي هذا (Simg). إنه نظيف بما فيه الكفاية للأغراض المعدنية ويستخدم كمكون من السبائك ومزيل الأكسدة للفولاذ (تحسين مقاومة التآكل وقمع الأسمنت) وكمادة خام لإنتاج سيلاني عبر عملية Müller-Rochow ، والتي تعمل في النهاية بشكل أساسي لإنتاج السيليكون. بالنسبة لإنتاج السيليكون الحديدي لصناعة الصلب (مزيل الأكسدة في عملية فرن الصهر) ، يتم تنفيذ التفاعل اللاحق على وجه السرعة في وجود الحديد الأولي.
إمكانيات الهضم الإضافية لـ SiO2 هي:
هضم الصودا عند حوالي 1600 ° C في خزان الانصهار:
الهضم الحراري المائي عند حوالي 200 ° C مع الماء في الأوتوكلاف:
السيليكون الشمسية
لإنتاج الخلايا الشمسية ، يجب تنقية السيليكون الخام إلى السيليكون الشمسي (Sisg). هناك إجراءات مختلفة لهذا. هذه الطرق هي الجزء الأكثر كثافة للطاقة في إنتاج الوحدات الشمسية بسبب العديد من الخطوات الوسيطة المعقدة. لذلك ، يتم الآن اختبار واستخدام أساليب التصنيع المختلفة مثل طريقة UMG (الدرجة المعدنية المطورة) وطريقة FBR (مفاعل السرير المميعة).
والبديل الخالي من الكلور هو تحلل المونوسيلان ، الذي يتحلل مرة أخرى بعد خطوة التنظيف على الأسطح الساخنة أو عند المرور عبر مفاعلات الطبقة المميعة.
السيليكون متعدد الكريستالات (البولي سيليكون) الذي تم الحصول عليه بهذه الطرق مناسب لإنتاج الوحدات الشمسية وله نقاوة تزيد عن 99,99٪. في تكنولوجيا الطاقة الشمسية ، كما هو الحال في الإلكترونيات الدقيقة ، يتم استغلال خصائص أشباه الموصلات للسيليكون.
فقط ذات الاهتمام التاريخي هو الإجراء الذي تم استخدامه مسبقًا من قبل شركة DuPont. استند إلى تقليل رابع كلورسيلان مع بخار الزنك الأولي عند درجات حرارة 950 ° C.
نظرًا للمشاكل الفنية والكمية الكبيرة من نفايات كلوريد الزنك ، لم تعد هذه العملية تُستخدم اليوم.
أشباه الموصلات السيليكون
أحادي البلورية أشباه الموصلات السيليكون
للتطبيقات في الإلكترونيات الدقيقة ، هناك حاجة إلى السيليكون عالي النقاوة أحادي البلل (Sieg). على وجه الخصوص ، يجب جعل الملوثات بالعناصر المناسبة أيضًا كعناصر المنشطات في تركيزات أقل من قيم حرجة معينة عن طريق السحب بوتقة أو ذوبان المنطقة. تعلن الشركة المصنعة Shin-Etsu عن "11N" -ref (= 99,999 999 999٪) من سبائكها.
في عملية سحب بوتقة (عملية Czochralski) ، يتم إذابة السيليكون الشمسي الناتج عن عملية Siemens في بوتقة كوارتز. يتم وضع بلورة بذرة السليكون أحادية البلورية عالية النقاء في هذا المصهور ويتم سحبها ببطء من الذوبان أثناء الدوران لتبلور السليكون عالي النقاء في صورة أحادية البلورة تاركةً جميع الملوثات تقريبًا في المصهور. الخلفية الفيزيائية لعملية التطهير هذه هي اكتئاب نقطة الانصهار وميل المواد لتبلورها قدر الإمكان.
بدلاً من ذلك ، أثناء ذوبان المنطقة بمساعدة مسخن تحريض كهربائي (على شكل حلقة) ، يتم تمرير منطقة مصهورة عبر قضيب سيليكون ، حيث يذوب جزء كبير من الملوثات في الذوبان ويهاجر معها.
يعتبر السيليكون البلوري عالي النقاء أكثر المواد الأساسية ملاءمةً للإلكترونيات الدقيقة ؛ أقل فيما يتعلق بخصائصها الكهربائية مقارنة بالخصائص الكيميائية والفيزيائية والتقنية للسيليكون ومركباته (ثاني أكسيد السيليكون ، نيتريد السيليكون ، إلخ). تستخدم جميع شرائح الكمبيوتر الشائعة والذاكرة والترانزستورات وما إلى ذلك السيليكون عالي النقاء كمواد أولية. وتستند هذه التطبيقات إلى حقيقة أن السيليكون هو أشباه الموصلات. من خلال الدمج المستهدف للشوائب (المنشطات) ، مثل الإنديوم أو الأنتيمون أو الزرنيخ أو البورون أو الفوسفور ، يمكن أن تختلف الخصائص الكهربائية للسيليكون داخل نطاق واسع. قبل كل شيء ، من خلال تأثيرات الوصلات PN الناتجة عن ذلك ، يمكن تحقيق مجموعة متنوعة من الدوائر الإلكترونية. بسبب الأهمية المتزايدة للدوائر الإلكترونية ، يتحدث المرء أيضًا عن عصر السيليكون. يشير اسم وادي السيليكون لمنطقة التكنولوجيا الفائقة في كاليفورنيا إلى الأهمية الكبيرة للسيليكون في صناعة أشباه الموصلات والكمبيوتر.
يمكن تحويل السيليكون غير المتبلور إلى السيليكون متعدد الكريستالات باستخدام أشعة الليزر excimer. هذا أمر ذو أهمية متزايدة لصناعة ترانزستورات الأغشية الرقيقة (TFT) لشاشات العرض المسطحة.
رقاقة السيليكون
السيليكون متاح تجاريا على حد سواء مسحوق ناعم والحبيبات الكبيرة. عادةً ما يتم إنتاج السيليكون عالي النقاء للاستخدام في الوحدات الشمسية أو في مكونات أشباه الموصلات في شكل أقراص رقيقة من البلورات الفردية ، تسمى رقائق السيليكون (انظر الشكل). بسبب الاستثمار الأولي العالي وأوقات البناء الطويلة للأفران اللازمة ، إلا أن عددًا قليلاً من الشركات في جميع أنحاء العالم تنتج السيليكون الخام.
أكبر منتجي السيليكون المعدني هم:
- Elkem (N ، الولايات المتحدة الأمريكية)
- إنفينسيل (F ، الولايات المتحدة الأمريكية)
- جلوب ميتالورجي (الولايات المتحدة الأمريكية)
- ريما ميتال (فرع)
هناك حوالي 15 من كبار المنتجين الآخرين. هناك عدد من الأعمال الأصغر في جمهورية الصين الشعبية ، مما يجعلها أكبر منتج في البلاد.
إن سوق البولي سيليكون وسيليكون فرط النقوش في مرحلة انتقالية منذ منتصف 2000s. بسبب ارتفاع الطلب على صناعة الطاقة الشمسية ، وصل 2006 إلى نقص في السيليكون.
الخصائص الفيزيائية
السيليكون ، مثل الجرمانيوم ، الغاليوم ، الفوسفور والأنتيمون المجاور للجدول الدوري ، هو أشباه الموصلات عنصري. المسافة النشطة بين شريط التكافؤ وشريط التوصيل وفقًا لنموذج الشريط هي 1,107 eV (في درجة حرارة الغرفة). عن طريق المنشطات بعناصر المنشطات المناسبة مثل البورون أو الزرنيخ ، يمكن زيادة الموصلية بعامل 106. في السيليكون المخدر بهذه الطريقة ، يكون خط الشوائب الناتج عن الشوائب وعيوب الشبكة أكبر بكثير من الخط الداخلي ، ولهذا السبب يشار إلى هذه المواد باسم أشباه الموصلات الشوائب. المعلمة الشبكة هي 543 مساء.
طيف معامل الانكسار المركب (N = n + ik) من السيليكون
يظهر معامل الانكسار المعقد ، الذي يعتمد على الطول الموجي للضوء ، في الصورة المجاورة. هنا ، أيضًا ، يمكن قراءة معلومات حول بنية النطاق. يُظهر المسار المتزايد بشدة لمعامل الانقراض k انتقالًا مباشرًا للنطاق عند 370 نانومتر (E1 = 3,4 فولت). يمكن ملاحظة انتقال نطاق مباشر آخر عند ≈ 300 نانومتر (EΓ2 = 4,2 فولت). لا يمكن تخمين الانتقال غير المباشر لنطاق السيليكون (على سبيل المثال = 1,1 فولت). يمكن رؤية حقيقة وجود انتقالات إضافية غير مباشرة في النطاق من المنحنى العريض لـ k للأطوال الموجية> 400 نانومتر.
مثل الماء وبعض المواد الأخرى ، يحتوي السيليكون على شذوذ الكثافة: كثافته في شكل سائل (عند Tm = 1685 K) أعلى من 10-11٪ مقارنة بالشكل الصلب والبلوري (c-Si) بواسطة 300 K.
الخواص الكيميائية
في كل ما يحدث في الطبيعة وفي الغالبية العظمى من المركبات المنتجة صناعياً ، يشكل السيليكون روابط حصرية. يعود سبب استقرار الرابطة الفردية Si-O على عكس الرابطة المزدوجة CO إلى طابع الرابطة المزدوج الجزئي ، والذي ينتج عن تداخل أزواج الأكسجين الوحيدة مع مدارات السيليكون الفارغة. قاعدة الرابطة المزدوجة ، التي طالما اعتبرت صالحة ، والتي تعتبر السيليكون عنصرًا من عناصر 3. ومع ذلك ، في هذه الأثناء ، أصبح عتيقًا لأن عددًا كبيرًا من المركبات المنتجة صناعياً مع روابط Si-Si المزدوجة معروفة الآن. في 2004 ، كان أول مركب له رابطة ثلاثية Si-Si يتميز هيكلياً.
باستثناء حمض الهيدروفلوريك الذي يحتوي على حمض النتريك (والذي يتكون من سداسي فلورو سليكات) ، يكون السيليكون غير قابل للذوبان في الأحماض لأن التخميل يحدث من خلال تكوين طبقة سيليكا صلبة. من ناحية أخرى ، يذوب بسهولة في القلويات الساخنة الكاوية مع تكوين الهيدروجين. على الرغم من إمكاناته السلبية الطبيعية (-0,81 V) ، فإنه خامل نسبيًا في شكله المضغوط ، حيث يغطي نفسه بطبقة أكسيد واقية في الهواء.
الخواص الميكانيكية
الخصائص الميكانيكية للسيليكون متباين الخواص (اتجاهي). اعتمادًا على الاتجاه البلوري المحدد ، يفترض معامل المرونة القيم بين 130 GPa و 189 GPa. ويرد وصف عام للسلوك المرن في تدوين Voigt كما هو الحال بالنسبة لجميع البلورات المكعبة عبر الثوابت المرنة المستقلة الثلاثة C11 و C12 و C44. مصفوفة المرونة للسيليكون:
الثوابت المرنة لها القيم التالية:
يمكن حساب المعادلات المرنة ذات الصلة من الثوابت المرنة لاتجاهات الكريستال الرئيسية الفردية للسيليكون (100,110 و 111):
النظائر
هناك ما مجموعه نظائر 23 بين 22Si و 45Si من السيليكون المعروف. من هذه ، ثلاثة ، النظائر 28Si ، 29Si و 30Si ، مستقرة وتحدث بشكل طبيعي. النظير ذو الحصة الأكبر من التكوين النظائري الطبيعي هو 28Si مع 92,223٪ ، 29Si لديه حصة 4,685٪ و 30Si من 3,092٪. النظائر غير المستقرة الأطول عمرًا هي 32Si ، والتي تدخل في 153P (الفسفور) مع عمر نصف يبلغ 32 سنوات تحت تحلل بيتا ، و 31Si ، التي تتحلل أيضًا إلى 157,36P تحت فترة تدهور بيتا مع نصف عمر 31 دقيقة. جميع النظائر الأخرى لها عمر نصف قصير فقط من الثواني أو ميلي ثانية.
يتكون 28Si في نجوم ثقيلة قرب نهاية تطورها بكميات كبيرة (حرق الأكسجين). هذا هو السبب في ارتفاع نسبة 28Si في إجمالي السيليكون (92,23٪) وأيضًا في تواتر السيليكون مقارنة بالعناصر الأخرى. منذ 2009 ، بذلت محاولات لإعادة تعريف كيلوغرام وحدة SI الأساسية كمجموعة معينة من ذرات 28Si ؛ أدت هذه المحاولات 2018 إلى تعريف جديد في نوفمبر. مستقرة أيضا هي النظائر 29Si (حصة 4,67 ٪ من مجموع السيليكون) و 30Si (3,1 ٪).
يتحلل النظير المشع 31Si بسرعة (نصف عمر 157,3 دقيقة) بسبب الإشعاع التجريبي للفسفور المستقر. يمكن استخدام هذا الظرف لإنتاج سيليكون متجانس بشكل كبير. لهذا الغرض ، يتم تشعيع السيليكون بالنيوترونات ، عن طريق التقاط النيوترونات ثم ينشأ 31Si وبالتالي 31P. مصدر النيوترون المناسب لهذه الطريقة هو مصدر النيوترون البحثي هاينز ماير-لايبنيتز. أكثر دواما هي 32Si مع عمر افتراضي يبلغ 172 سنة. تتشكل آثار هذا النظير في الغلاف الجوي للأرض عن طريق تشظي الأرجون بالإشعاع الكوني. يتحلل 32Si إلى 32P المشع بالتساوي (أيام 14,3 نصف العمر) ، ثم إلى 32S المستقر (الكبريت). جميع النظائر الأخرى تتفكك في غضون ثوان قليلة.
SICHERHEIT
السيليكون عبارة عن مسحوق قابل للاحتراق مثل العديد من العناصر. كما مسحوق وحبيبات أنها مزعجة. السيليكون المضغوط غير ضار.
يمكن أن يكون السيليكون المهدرج ، أي السطحي المغطى بالهيدروجين المسامي ، شديد الانفجار تحت أشعة الليزر وزيادة الأكسجين ، كما اكتشف الباحثون في جامعة ميونخ التقنية بالصدفة. انفجار في نطاق ميكرومتر ممكن. تعد سرعة التفجير وطاقة التفجير أعلى من تلك الخاصة بـ TNT والديناميت.
استخدام في التكنولوجيا
اكتشفت 1947 جون باردين ، وولتر براتين وويليام شوكلي المقاومة الكهربائية التي يمكن السيطرة عليها ، والترانزستور ، لأول مرة على الكريستال الجرمانيوم واحد. لا يمكن عزل السيليكون البهيجة للاتصال إلا في وقتٍ لاحقٍ في النقاء الضروري للأغراض الإلكترونية. قام 1958 Robert Noyce من شركة Fairchild و Jack S. Kilby من شركة Texas Instruments بتطوير الدائرة المتكاملة (IC) بشكل مستقل على رقاقة سيليكون. منذ حوالي 1970 ، يعتبر السيليكون هو المادة الأساسية لمعظم منتجات أشباه الموصلات وهو المادة الأساسية للعديد من أجهزة الاستشعار والأنظمة الميكانيكية الدقيقة الأخرى (مثل ذراع الرافعة في مجهر القوة الذرية). السيليكون هو أيضا العنصر الأساسي لمعظم الخلايا الشمسية.
في نوفمبر تم الإبلاغ عن 2005 عن أول نتائج واعدة باستخدام أشعة الليزر السيليكونية.
يستخدم السيليكون كوقود عالي الطاقة في العديد من المتفجرات.
منذ أن تمدد السيليكون عند التصلب ، في حين تقلصت معظم المواد ، تتم إضافته إلى العديد من سبائك الصب. على سبيل المثال ، يحتوي الحديد الزهر دائمًا على 2٪ Si. تكتسي سبائك الألمنيوم والسليكون أهمية خاصة حيث يمكن أن يصل محتوى Si إلى 20٪. هذا هو أهم مجموعة متنوعة من جميع المواد الألومنيوم المصبوب.
روابط
السيليكون دائما تقريبا رباعي التكافؤ في المركبات الكيميائية. وفقا لذلك ، فإن ذرة السيليكون في المركبات عادة ما تكون أربعة إحداثي. بالإضافة إلى ذلك ، هناك الآن عدد من المركبات التي يكون فيها للسيليكون خمسة أو ستة أضعاف التنسيق. بالإضافة إلى السيليكون رباعي التكافؤ والمركبات المحضرة صناعيا من السيليكون ثنائي التكافؤ (silylenes) معروفة ، ولكن معظمها غير مستقر للغاية. الأكثر أهمية هو فقط أول أكسيد السيليكون ، والذي يستخدم كمادة لتعويض العدسات البصرية. بالإضافة إلى ذلك ، اكتشف 2012 تجريبيًا أيضًا مركبًا ثلاثي الإحداثيات مماثلًا للبنية أحادية البعد للجرافين ، وهو ما يسمى السيليسين.
تتميز كيمياء السيليكون بأكملها أساسًا بتقارب السيليكون العالي للأكسجين. عادةً ما يكون السيليكون هو الشريك الكهربي للمركب الكيميائي ، على الرغم من وجود مركبات تحتوي على السيليكون الذي تم نفيه رسميًا. هذه في الغالب مبيدات حشرية حيث يمكن للسيلكون أن يشكل أيضًا أنيونات حقيقية.
![]()
انعكاس قطبية ملزمة
تجدر الإشارة بشكل خاص إلى انعكاس قطبية الروابط لسندات عنصر الهيدروجين في الانتقال من الكربون إلى السيليكون. هنا ، يتغير الاختلاف في الكهربية من + 0,45 (هيدروجين الكربون) إلى -0,2 ، وهذا هو السبب في أن مركبات السيلاني لها تفاعلات مختلفة تمامًا عن الهيدروكربونات.
يمكن تقسيم أهم مركبات السيليكون إلى الفئات التالية ، والتي ذكر بعض الممثلين فيها:
اتصالات ثنائية
- كربيد السيليكون
- السيليكا
- نيتريد السيليكون
- silicides
السليكات
- الزركون وجميع السيليكات الأخرى ومركبات حمض السيليك
هاليدات السيليكون
- رابع فلوريد السليكون
- رابع كلوريد السيليكون
- ترايكلوروسيلان (سيليكوكلوروف)
هدريدات السيليكون
- monosilane
- سيلاني
مركبات السيليكون العضوية
- رباعي ميثيل سيلان (TMS ، الرنين المغناطيسي النووي قياسي)
- ميثيل كلورسيلان مثل ديكلوروميثيل سيلان (لبنات بناء للسيليكونات)
- phenylchlorosilane
- carbosilanes
- Carbosilazane
- carbosiloxanes
مركبات السيليكون البوليمرية
- تتكون السيلكونات (السيليكات ، polyorganosiloxanes) عن طريق البلمرة وتنتمي إلى أهم المواد البلاستيكية الصناعية.
- تجد مركبات الأكسجين والسليكون البوليمرية تطبيقًا في العديد من المناطق ؛ أنها بمثابة زيوت التشحيم والمواد المانعة للتسرب في صناعة مستحضرات التجميل والبناء.
- Polysilanes ، كربوسيلان ، carbosilazanes ، كربوسيلوكسان
آخر
حتى يومنا هذا ، غالبًا ما تكون الكلمة الإنجليزية "silicon" (للسيلكون) مترجمة بشكل خاطئ أو واضحة في مقالات علمية شهيرة أو في دبلجة للأفلام باسم "سيليكون" ("سيليكون"). حدث هذا ، على سبيل المثال ، في سلسلة الخيال العلمي "ستار تريك" ، فيلم جيمس بوند التشويقي في مواجهة الموت أو في سلسلة الرسوم المتحركة The Simpsons. مثال: "هل شكل الحياة مصنوع من الكربون أو السيليكون؟"
أسعار السيليكون
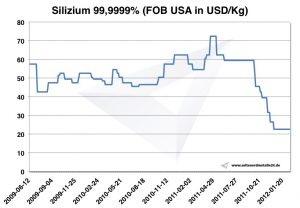
مخطط السيليكون 2009-2012





















