التنتالوم ، تا ، العدد الذري 73
سعر التنتالوم وحدوثه واستخراجه واستخدامه
التنتالوم [ˈtantalum] هو عنصر كيميائي برمز Ta والرقم الذري 73 ؛ في الجدول الدوري يوجد في المجموعة الفرعية الخامسة أو مجموعة الفاناديوم. إنه معدن انتقالي نادر الحدوث ، مطيل ، رمادي الجرافيت ، لامع. يستخدم التنتالوم بشكل أساسي للمكثفات ذات السعة العالية وفي نفس الوقت الحجم الصغير. نظرًا لأن المعدن غير سام وخامل في سوائل الجسم ، فإنه يستخدم أيضًا في عمليات الزرع ، على سبيل المثال كأظافر العظام.
تم اكتشاف العنصر في عام 1802 من قبل Anders Gustav Ekeberg في خام كولومبيت الفنلندي. قام بفصل أكسيد مستقر جدًا (أكسيد التنتالوم (V)) الذي لم يذوب في أي حمض. سميت على اسم Tantalus ، شخصية من الأساطير اليونانية. وفقًا لإيكبيرج ، فإن سبب هذا الاسم هو أن الأكسيد الدائم جدًا "يجب أن يذبل ولا يمكنه أن يروي عطشه ، مثل تانتالوس في العالم السفلي".
في نفس الوقت تقريبًا ، وجد تشارلز هاتشيت شيئًا مشابهًا جدًا في خام كولومبي الكولومبيوم. كان يُعتقد أن هذين العنصرين متطابقان حتى عام 1844 ، عندما أدرك هاينريش روز وجود عنصرين مختلفين في خامات كولومبيت ، وهما التنتالوم والكولومبيوم. دعا الأخير النيوبيوم.
بعد اكتشاف العنصر الجديد ، حاول العديد من الكيميائيين تمثيل التنتالوم في شكل عنصري. أول من أنتج التنتالوم العنصري عن طريق تقليل فلوريد التنتالوم بالبوتاسيوم كان يونس جاكوب برزيليوس في عام 1815. ومع ذلك ، مثل التنتالوم الذي يمثله روز ، كان معدنه يتألف من 50٪ فقط من التنتالوم. في عام 1902 ، حاول Henri Moissan إنتاج التنتالوم في فرن كهربائي ، لكن الكربون الذي يحتويه جعل منتجه صعبًا وهشًا للغاية.
كان فيرنر فون بولتون أول من أنتج التنتالوم النقي المطيل في عام 1903. وقد حقق ذلك عن طريق تقليل الأكاسيد المتوهجة في الفراغ ومن خلال إذابة معدن التنتالوم غير النقي في فراغ واستخدام قوس لهب كهربائي.
كان أول تطبيق للعنصر الجديد بمثابة خيوط في المصابيح الكهربائية. كان سبب التغيير من الأوزميوم المستخدم سابقًا إلى التنتالوم هو أنه من الأسهل معالجته ولديه درجة حرارة قابلة للاستخدام أعلى تصل إلى 2300 درجة مئوية. تم استبداله لاحقًا بالتنغستن ، الذي له نقطة انصهار أعلى وبالتالي يتيح طيفًا ضوئيًا أقرب إلى ضوء الشمس وإخراج ضوئي أعلى.
في عام 1922 تم العثور على تطبيق جديد للتنتالوم مع استخدامه في المقومات وبعد عام واحد في أنابيب الراديو.
ظهور
التنتالوم عنصر نادر على الأرض بمحتوى 2 جزء في المليون في القشرة القارية و 8 جزء في المليون في قشرة الأرض. التردد مماثل لتكرار الزرنيخ والجرمانيوم. داخل المجموعة ، ينخفض التردد بقوة عشرة. لا يحدث التنتالوم بشكل طبيعي ، ولكن فقط في شكل مركباته من معادن مختلفة. بسبب تشابه العنصرين ، تحتوي خامات التنتالوم دائمًا على النيوبيوم والعكس صحيح (التنشئة الاجتماعية). أهم المعادن هي تلك الموجودة في سلسلتي columbite و tapiolite ، حيث تحتوي على معادن مختلفة ذات الصيغة العامة (Mn، Fe2+) (ملحوظة، تا)2O6 تلخيص. وتسمى أيضا الكولومبيت التانتالوم تنتالايت المحددة. ومن أمثلة المعادن المحتوية على التنتالوم في هذه السلسلة فيروتابوليت (Fe2+، من2+) (تا ، ملحوظة)2O6 والمنغنيز التانتاليت MnTa2O6. غالبًا ما يشار إلى هذه الخامات باسم الكولتان. المعادن الأقل شيوعًا هي الميكروليت أو الثوريوليت.
وكانت أهم الدول المنتجة لخامات التنتالوم عام 2007 هي أستراليا ب 850 طنا والبرازيل 250 طنا. تم العثور على الكولتان أيضًا في كندا ودول أفريقية مختلفة مثل إثيوبيا وموزمبيق ورواندا. أصبحت الرواسب في شرق جمهورية الكونغو الديمقراطية ، والتي كانت موضع نزاع حاد في حرب الكونغو 1996-2008 ، معروفة في وسائل الإعلام.
استخراج والعرض
نظرًا لأن التنتالوم والنيوبيوم موجودان دائمًا معًا في الخامات المستخدمة في استخراج التنتالوم ، يجب فصلهما لاستعادة المعادن النقية. هذا الأمر معقد بسبب التشابه الكبير بين العنصرين.
تم تطوير الطريقة الأولى للفصل من قبل جان تشارلز جاليسار دي مارينياك في عام 1866. استخدم قابلية الذوبان المختلفة للعنصرين في حمض الهيدروفلوريك المخفف. يشكل التنتالوم K القابل للذوبان بشكل طفيف2الطف7، Niobium للذوبان جيدا K3NbOF5 2 H2O.
تعتمد العملية المستخدمة تقنيًا اليوم على الاستخلاص وتستخدم قابلية الذوبان المختلفة لأملاح الفلور المعقدة في الماء وبعض المذيبات العضوية. يتم أولاً إذابة خليط الركاز في حمض الهيدروفلوريك المركز أو خليط من حمض الهيدروفلوريك وحمض الكبريتيك. الفلوريدات المعقدة [NbOF5]2- و [الطائف7]2-. بعد تصفية المكونات غير القابلة للذوبان ، يمكن إجراء الفصل عن طريق استخلاص سائل-سائل بمساعدة ميثيل أيزوبوتيل كيتون. إذا تمت إضافة ميثيل أيزوبوتيل كيتون إلى المحلول ، فإن معقدات النيوبيوم والتنتالوم تنتقل إلى الطور العضوي ، بينما تبقى العناصر الأخرى ، مثل الحديد أو المنغنيز ، في المرحلة المائية. عند إضافة الماء إلى الطور العضوي المنفصل ، يذوب فيه مركب النيوبيوم فقط ، ويبقى التنتالوم في كيتون إيزوبوتيل الميثيل.
بمساعدة فلوريد البوتاسيوم ، يمكن تحويل التنتالوم إلى ك ضعيف الذوبان2[الطف7] تقطع. عادة ما يتم الاختزال إلى عنصر التنتالوم بواسطة الصوديوم.
![\ mathrm {K_2 [TaF_7] + 5 \ Na \ longrightarrow Ta + 5 \ NaF + 2 \ KF}](https://upload.wikimedia.org/wikipedia/de/math/4/0/8/4082df7e6f3cde8acd65ddf4230284e5.png)
تخفيض مع الصوديوم
بديل محتمل للاستخراج هو التقطير التجزيئي. تستخدم نقاط الغليان المختلفة لكلوريد النيوبيوم خماسي كلوريد والتنتالوم خماسي كلوريد لهذا الغرض. يمكن الحصول عليها في درجات حرارة عالية من الخامات التي تحتوي على الكلور وفحم الكوك. بعد الفصل ، يتم أيضًا تقليل كلوريد التنتالوم إلى المعدن بالصوديوم.
بالإضافة إلى خامات الكولومبيت والتانتاليت ، يعد الخبث الناتج عن صهر القصدير مصدرًا مهمًا لاستخراج التنتالوم (يحتوي على نسبة قليلة من التنتالوم).
الخصائص الفيزيائية

التركيب البلوري للتنتالوم ،a = 330,3 مساءً
التنتالوم عبارة عن معدن ثقيل شديد الانصهار يشبه النيوبيوم في معظم خواصه بلون رمادي أرجواني ، صلب (صلابة فيكرز: 60-120 HV). يتبلور في هيكل بلوري مكعب محوره الجسم. مع نقطة انصهار تبلغ حوالي 3000 درجة مئوية ، يتمتع التنتالوم بأعلى نقطة انصهار لجميع العناصر بعد التنغستن والكربون والرينيوم. إذا تم تخزين كمية صغيرة فقط من الكربون أو الهيدروجين في المعدن ، فإن نقطة الانصهار تزداد بشكل كبير. مع نقطة انصهار تبلغ 3880 درجة مئوية ، يحتوي كربيد التنتالوم على واحدة من أعلى نقاط الانصهار لجميع المواد.
يصبح التنتالوم موصلًا فائقًا تحت درجة حرارة انتقالية تبلغ 4,3 كلفن.
في حين أن التنتالوم النقي مطيل ويمكن أن يتمدد بشكل كبير (قوة الشد: 240 ميجا باسكال) ، حتى الكميات الصغيرة من الكربون أو الهيدروجين المضافة إليه تغير القوة الميكانيكية بشكل كبير. تصبح المادة هشة ويصعب معالجتها. يستخدم هذا التأثير لإنتاج مسحوق التنتالوم. في التكنولوجيا ، يتم تحميله بالهيدروجين وبالتالي يتم تقشيره ، ثم طحنه وفقًا لذلك وخبزه أو تحريره من الهيدروجين مرة أخرى عند درجة حرارة أعلى.
الخواص الكيميائية
التنتالوم هو معدن أساسي ويتفاعل في درجات حرارة عالية مع معظم اللافلزات ، مثل الأكسجين أو الهالوجينات أو الكربون. ومع ذلك ، في درجة حرارة الغرفة ، يتم حماية المعدن بطبقة رقيقة من أكسيد التنتالوم (V) وبالتالي تخميله. يحدث التفاعل فقط عند درجة حرارة حوالي 300 درجة مئوية.
في معظم الأحماض التنتالوم ليست قابلة للذوبان بسبب التخميل ، حتى ريجيا المائية لا يمكن حل المعادن. يتم مهاجمة التنتالوم فقط بواسطة حمض الهيدروفلوريك ، الزيت (خليط من حامض الكبريتيك وثاني أكسيد الكبريت) وأملاحه المنصهرة.
النظائر
يوجد ما مجموعه 30 نظيرًا و 26 من الأيزومرات الأساسية 155تا يصل 185تا معروف. يتكون التنتالوم الطبيعي بشكل حصري تقريبًا (99,988٪) من النظير 181يوجد أيضًا Ta. 0,012٪ من الأيزومير الأساسي 180mتا من قبل. على الرغم من أن هذا يمكن أن يكون إشعاعيًا من الناحية النظرية ، إلا أنه لم يلاحظ أي انحلال حتى الآن لذلك يجب أن يتجاوز نصف العمر 1 · 1015 يكون عاما.
استعمال
يستخدم معظم التنتالوم (حجم الإنتاج السنوي العالمي 1.400 طن) للمكثفات الصغيرة جدًا ذات السعة العالية. في عام 2007 ، تم استخدام 60٪ من التنتالوم في صناعة المكثفات. تُستخدم مكثفات التنتالوم الإلكتروليتية في كل مكان في الإلكترونيات الدقيقة الحديثة ، على سبيل المثال للهواتف المحمولة وفي صناعة السيارات. يعتمد التأثير على طبقة أكسيد التنتالوم الموجودة على سطح رقائق التنتالوم الجرح ، والتي لا تزال مستقرة وعازلة بشكل موثوق حتى في النسخة الرقيقة جدًا. كلما كانت الطبقة أرق بين الأقطاب الكهربائية ، زادت السعة بنفس سطح الرقاقة ؛ بالإضافة إلى ذلك ، يتمتع أكسيد التنتالوم بسماحية عالية للغاية ، مما يزيد أيضًا من السعة.
نظرًا لأن التنتالوم غير سام ولا يتفاعل مع أنسجة الجسم أو السوائل ، فإن عنصر التنتالوم يستخدم في الغرسات والأدوات الطبية. على سبيل المثال ، تصنع مسامير العظام والأطراف الاصطناعية والأقواس ومسامير الفك من التنتالوم. بالإضافة إلى ذلك ، فهو عبارة عن وسيط تباين للأشعة السينية نادرًا ما يستخدم بسبب ارتفاع تكاليفه.
يستخدم التنتالوم في الصناعة الكيميائية بسبب متانته. تعمل كمواد تبطين لأوعية التفاعل وتستخدم للمبادلات الحرارية والمضخات. في معظم الحالات ، لا يستخدم التنتالوم النقي لهذه الأغراض ، ولكن السبائك التي تحتوي على 2,5-10٪ تنجستن. وهي أكثر استقرارًا ومقاومة من التنتالوم النقي. في الوقت نفسه ، يتم الاحتفاظ بالليونة المرغوبة. الاستخدامات الأخرى هي المعدات المختبرية والمغازل وكاثودات أنابيب الإلكترون. هنا ، يستفيد التنتالوم من حقيقة أنه قادر على امتصاص ما يصل إلى 800 جزءًا من حجم الغازات عند 740 درجة مئوية (تأثير getter) ، مما يضمن تفريغًا عاليًا في الأنابيب.
تحتوي السبائك الفائقة ، التي تستخدم في بناء التوربينات ومحركات الطائرات ، على ما يصل إلى 9٪ من التنتالوم. إن إضافة 3-4٪ من التنتالوم إلى سبائك النيكل الفائقة تزيد من قوة المادة في درجات الحرارة العالية.
سلامة
عادة لا يسبب العمل مع التنتالوم ومركباته أي مشاكل تحت ظروف المختبر. مركبات التنتالوم والتنتالوم الأولية ليست سامة. ومع ذلك ، هناك مؤشرات غامضة على أن بعض مركبات التنتالوم مسببة للسرطان. يشكل مسحوق التنتالوم والغبار - مثل المعادن الأخرى المقسمة بدقة - مخاطر عالية لحدوث حريق وانفجار.
روابط
أكسيد التنتالوم (V) تا2O5 هو مسحوق أبيض يستخدم لصنع نظارات عالية الانكسار ومواد كريستال خاصة.
كربيد التنتالوم TaC ، مع درجة حرارة انصهاره البالغة 3880 درجة مئوية وصلابة تقارب صلابة الألماس ، يعمل كطبقة واقية على السبائك عالية الحرارة في المحركات وأدوات القطع.
| عموما | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| الاسم والرمز والرقم الذري | التنتالوم ، تا ، 73 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سلسلة | الفلزات الإنتقالية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة ، الفترة ، الكتلة | 5 ، 6 ، د | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مظهر | غراو | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد CAS | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جزء من كتلة الأرض قذيفة | 8 جزء في المليون | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نووي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 180,9479 ش | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف القطر الذري (محسوب) | 145 (200) مساءً | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر التساهمية | 138 PM | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | [Xe] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. التأين | 761 كيلو جول / مول | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. التأين | 1500 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بدنيا | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الحالة الفيزيائية | مهرجان | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التركيب البلوري | محورها الجسم مكعب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة | 16,65 جم / سم3 (20 درجة مئوية) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلابة موس | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مغنطيسية | بارامغناطيسية ( = 1,8 10-4) = 1,8 10-4) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| درجة الإنصهار | 3290 كلفن (3017 درجة مئوية) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 5731 كلفن (5458 درجة مئوية) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حجم المولي | 10,85 · 10-6 m3/ مول | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 735 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 36 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت | 3400 م / ث في 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| قدرة حرارة محددة | 140 J / (كجم · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الموصلية الكهربائية | 7,61 · 106 A / (V · m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توصيل حراري | 57 واط / (م · ك) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كيميائي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التأكسد | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| إمكانات طبيعية | −0,81 فولت (½ تا2O5 + 5 هـ.+ + 5 هـ- → تا + 2½ ح2O) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهربية | 1,5 (مقياس بولينج) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خصائص NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سلامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
أسعار التنتالوم
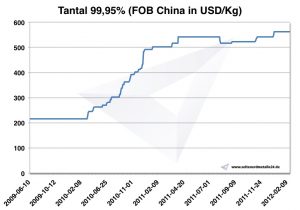
الرسم البياني التنتالوم 2009-2012
أسعار التنتالوم الحالية


