اللانثانم ، لا ، العدد الذري 57
عام
اللانثانوم [lantaːn] هو عنصر كيميائي برمز العنصر La والرقم الذري 57. إنه ينتمي إلى معادن الانتقال وكذلك معادن التربة النادرة ، في الجدول الدوري يقف في 6. الفترة و 3. مجموعة فرعية (مجموعة 3) أو مجموعة سكانديوم. في الغالب يتم حسابه أيضًا باللانثانويدين ، حتى لو كانت الشظية f للعنصر غير مشغولة.
Lanthanum (اليونانية λανθάνειν ، lanthanein ، "لتكون مخفية") اكتشف 1839 من قبل الكيميائي والجراح السويدي كارل غوستاف موساندر. من نترات السيريوم المفترض أنها فازت بلورة كسور اللانثانم.
يحدث اللانثانم بشكل طبيعي فقط في المركبات الكيميائية المرتبطة باللانثانيدات الأخرى في المعادن المختلفة. أساسا هذه هي:
Monazite ((Ce، La، Th، Nd، Y) PO4)
Bastnäsit ((Ce، La، Y) CO3F)
انتعاش
بعد فصل معقد عن رفيق اللانثانيد الآخر ، يتفاعل الأكسيد مع فلوريد الهيدروجين إلى فلوريد اللانثانوم. في وقت لاحق ، يتم تقليل هذا إلى اللانثانم مع الكالسيوم لتشكيل فلوريد الكالسيوم. يتم فصل بقايا الكالسيوم والشوائب المتبقية في عملية إعادة صهر إضافية في الفراغ.
ملامح
المعدن الأبيض الفضي مرن وقوي. هناك ثلاثة تعديلات معدنية.
اللانثانم غير مهين. يتحول بسرعة إلى طبقة أكسيد أبيض في الهواء ، والتي تتفاعل في الهواء الرطب مع هيدروكسيد.
عند درجات حرارة أعلى من 440 ° C ، يحترق lanthanum بأكسيد اللانثانم (La2O3). يكون تكوين الهيدروجين في الماء البارد بطيئًا ، في الماء الدافئ ، يكون رد فعل سريعًا للهيدروكسيد ، إذ يذوب اللانثانوم في الأحماض المخففة تحت تطور الهيدروجين ، ويتفاعل مع العديد من العناصر مباشرة في الحرارة مع الهالوجين حتى في درجة حرارة الغرفة. يشكّل اللانثانوم والهيدروجين هيدراً غير مستوي مقايسة للماء حساسًا للماء.
استعمال
اللانثانوم هو أحد مكونات المعادن الضارة. تحتوي مواد الصوان Pyrophoric على Lanthanum من وزن 25 إلى 45. بالإضافة إلى ذلك ، يجد استخدامها كعامل مختزل في علم المعادن. كإضافة من الحديد الزهر ، فإنه يدعم تشكيل الجرافيت الكروي ، كمادة مضافة للسبائك ، فإنه يحسن مقاومة الأكسدة. المواد المضافة اللانثانم تقلل من صلابة وحرارة درجة حرارة الموليبدينوم.
تتكون الكاثودات عالية الجودة لتوليد الإلكترونات الحرة من هيكسابريد اللانثانم كبديل لسلك التنغستن. يستخدم أكسيد اللانثانم عالي النقاء في صناعة الزجاج لإنتاج نظارات عالية الجودة مع مؤشر انكسار عالي للبصريات z. B. تستخدم لعدسات الكاميرا.
مع الكوبالت:
يتم استخدام سبائك LaCo5 من الكوبالت-اللانثانوم كمواد مغنطيسية ، تيتانيت الباريوم المخدر المصنوع من اللانثانم لإنتاج مقاومات حرارية PTC (مقاومات تعتمد على درجة الحرارة). بالتزامن مع الكوبالت والحديد والمنغنيز والسترونتيوم وغيرها ، فإنه بمثابة كاثود لخلايا الوقود ذات درجة الحرارة العالية (SOFC). يستخدم النيكل اللانثانيوم "الملوث" (LaNi5) كمخزن للهيدروجين في بطاريات تخزين هيدريد معدن النيكل. بالإضافة إلى ذلك ، يأتي في مصابيح قوس الكربون لإضاءة الاستوديو وفي أنظمة عرض الأفلام (تطبيق تاريخي؟) من قبل.
مع التيتانيوم:
يعد هذا المعدن السبائكي ذو التراكيب المادية من اللانثانوم والتيتانيوم ، ويعزى إلى حقيقة أنه مع معالجة تشكيل الرقائق ، يتم تقليل طول الرقاقة. هذا ينبغي أن تسهل معالجة المعادن.
في مجال الطب ، يتم إنتاج الأدوات المقاومة للتآكل والتي يمكن تعقيمها بسهولة من السبائك المعدنية. ويقال إن هذه السبائك المعدنية القائمة على التيتانيوم مناسبة بشكل خاص للأدوات والأجهزة الجراحية لأن الميل إلى الحساسية لاستخدام مثل هذه السبائك المعدنية مع التيتانيوم بالنسبة للسبائك الأخرى يجب أن يكون منخفضًا.
كما أكسيد اللانثانم
إنتاج النظارات (Lanthanglas) ذات معامل إنكسار مرتفع نسبيًا ، والذي يتغير بدوره قليلاً فقط مع طول الموجة (تشتت منخفض) ، للكاميرات وعدسات التلسكوب وللعدسات النظارات
إنتاج الزجاج والكريستال والبقع والخزف. يحل محل مركبات الرصاص السامة أكثر مع تحسين المقاومة الكيميائية في وقت واحد (تحسين مقاومة القلويات ، "آمنة غسالة الصحون")
إضافة محفز للزيوليت أثناء تكسير الحفاز السائل في مصفاة النفط
إنتاج كتل المكثف السيراميك والنظارات الخالية من السيليكات
مكون من ملمعات الزجاج
إنتاج الكاثودات الساخنة لأنابيب الإلكترون (أيضًا بوريدات اللانثانم)
كما كربونات اللانثانم
دواء لخفض مستوى الفوسفات في مرضى غسيل الكلى (ما يسمى الموثق الفوسفات)
اللانثانوم يصنف على أنه منخفض السمية. جرعة سامة غير معروفة. ومع ذلك ، يعتبر مسحوق اللانثانوم شديد التآكل لأنه يتفاعل بسهولة شديدة ، على سبيل المثال عن طريق رطوبة الجلد ، لهيدروكسيد اللانثانوم الأساسي (على غرار عناصر الكالسيوم والسترونتيوم). الجرعة المميتة لدى الفئران هي 720 mg.
| عموما | |
| الاسم ، رقم الرمز | لانثانوم ، لا ، 57 |
| سلسلة | الفلزات الإنتقالية |
| المجموعة ، الفترة ، كتلة | 3 ، 6 ، د |
| مظهر | أبيض فضي |
| عدد CAS | 7439-91-0 |
| جزء من كتلة مظروف الأرض | 17 جزء في المليون |
| نووي | |
| الكتلة الذرية | 138,9055 u |
| نصف القطر الذري | 195 PM |
| نصف قطر التساهمية | 207 PM |
| Elektronenkonf. | [Xe] 5d (1) 6s2 |
| 1. التأين | 538,1 KJ / mol |
| 2. التأين | 1067 KJ / mol |
| 3. التأين | 1850 KJ / mol |
| بدنيا | |
| الحالة الفيزيائية | مهرجان |
| التركيب البلوري | مسدس الشكل |
| كثافة | 6,17 g / cm3 (20 ° C) |
| مغنطيسية | paramagnetic (χm = 5,4 * 10 (-5)) |
| درجة الإنصهار | 1193 K (920 C) |
| نقطة الغليان | 3743 K (3470 C) |
| حجم المولي | 22,39 * 10 (-6) m (3) / mol |
| حرارة التبخر | 400 KJ / mol |
| حرارة الانصهار | 6,2 KJ / mol |
| الموصلية الكهربائية | 1,626 * 10 (6) A / (V * m) |
| توصيل حراري | 13 W / (m * K) |
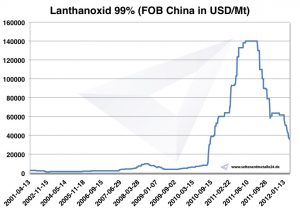
سعر اللانثانم