الزركونيوم ، Zr ، العدد الذري 40
سعر الزركونيوم ، حدوث ، استخراج واستخدام
الزركونيوم ، في كثير من الأحيان أيضا الزركونيوم، هو عنصر كيميائي برمز العنصر Zr والرقم الترتيبي 40. مشتق من اسم الزركون ، والمعادن الزركونيوم الأكثر شيوعا. في الجدول الدوري يكون في 5. الفترة؛ هذا هو العنصر الثاني من 4. مجموعة (عفا عليها الزمن 4 مجموعة فرعية) أو مجموعة تيتان. الزركونيوم معدن ثقيل مقاوم للتآكل. الوظائف البيولوجية غير معروفة ؛ وهو موجود بكميات صغيرة (4 مغ / كغ) في الكائن البشري وغير سامة.
يعتبر الزركون المعدني المهم المحتوي على الزركونيوم (Zr [SiO4]) عرفت باسم الأحجار الكريمة منذ العصور القديمة. تم اكتشاف الزركونيوم كعنصر في عام 1789 من قبل مارتن هاينريش كلابروث في عينة من معدن الزركون من سيلان وسميت باسمه. تم تقديم المعدن لأول مرة في عام 1824 بواسطة Jöns Jakob Berzelius من خلال تقليل K.2ZRF6 بالبوتاسيوم. للقيام بذلك ، سخن "مزيج من البوتاسيوم الزركونيوم المائي مع البوتاسيوم في أنبوب حديدي". بعد المعالجة بالماء والتجفيف والتسخين لفترات طويلة باستخدام حمض الهيدروكلوريك المخفف ، تلقى Berzelius a "مسحوق العقدي الذي يشبه الفحم الأسود" كان وفقط "من خلال الضغط على الفولاذ المصقول بلون رمادي غامق وتألق" تم الاستلام. من ناحية أخرى ، لا يمكن تحديد الكتلة الذرية الصحيحة حتى عام 1924 لأنه - إلى جانب الأخطاء في تنفيذ التجارب - لم يكن معروفًا أن الزركونيوم يحتوي دائمًا على كميات صغيرة من الهافنيوم. بدون هذه المعلومات ، أعطت القياسات دائمًا كتلة ذرية عالية جدًا. كان أول تطبيق عملي للزركونيوم هو مسحوق فلاش بدون دخان.
ظهور
يحدث الزركونيوم في قشرة الأرض مع محتوى حوالي 0,016٪. في قائمة العناصر المطلوبة للتردد ، يكون الزركونيوم على 18. مكان وأكثر شيوعا من العناصر المألوفة من الكلور والنحاس. على الرغم من انتشاره على نطاق واسع ، إلا أنه لا يوجد إلا بكميات صغيرة جدًا وفي بلورات صغيرة جدًا (عادةً حول 0,1 مم). لذلك ، يعتبر الزركونيوم نادرًا في العصور القديمة. يوجد الزركونيوم بشكل رئيسي في الصخور الدخيلة السيلكية مثل الجرانيت. لا تأتي كريمة ، ولكن فقط في بعض المعادن ، وخاصة الزركون (ZrSiO)4) و Baddeleyit (ZrO2) والنحل الأحمر النادر (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2) تعادل في الجبهة. يرتبط دائما تقريبا مع الهفنيوم. نظرًا لارتفاع درجة انصهارها بـ 2550 ° C ، وصلابتها العالية وتفاعلها المنخفض ، يعد الزركونيوم أقدم معدن يمكن العثور عليه على الأرض ويمكن استخدامه لتحديدات العمر الإشعاعي استنادًا إلى نظائر اليورانيوم والثوريوم المدمجة.
تستخدم الرواسب الثانوية ، التي تسمى رواسب الصابون ، في الغالب كمواد خام. تحدث هذه عندما يتم تجوية الصخور المحيطة ويبقى فقط الزركون المقاوم للعوامل الجوية. يمكن أن تنشأ رواسب أخرى من التيارات المائية التي تغسل بلورات الزركونيوم وتغسلها في أماكن أخرى. من ناحية أخرى ، عادةً ما تحتوي الرواسب الأولية على محتوى من الزركونيوم منخفض جدًا بالنسبة للتعدين المربح.

التطور الزمني لتعزيز الزركون
أهم رواسب الزركونيوم في أستراليا والولايات المتحدة الأمريكية والبرازيل. مع احتياطيات قابلة للاسترداد قدرها مليون طن من 38 ، بلغ الإنتاج السنوي العالمي من معادن الزركونيوم 2006 بالأطنان 920.000 (محسوبة على شكل زركونيوم). من هذه ، تتم معالجة حوالي 5٪ فقط للمعادن والسبائك. وكانت الدول المنتجة الرئيسية 2006 حتى الآن أستراليا وجنوب أفريقيا.
استخراج والعرض
يجب أولاً تحويل الزركونيوم ، وهو المادة الخام الأكثر شيوعًا من الزركونيوم ، إلى ثاني أكسيد الزركونيوم قبل المعالجة الإضافية. لهذا ، يتم غليان الزركون في ذوبان هيدروكسيد الصوديوم (الهضم القلوي). بعد ذلك يتفاعل الزركونيا مع فحم الكوك في القوس لتكوين كربونات الزركونيوم (الزركونيوم المحتوية على الكربون والنيتروجين) ثم مع الكلور لتشكيل رابع كلوريد الزركونيوم.

لا يمكن التقليل المباشر لثاني أكسيد الزركونيوم بالكربون (كما في عملية الفرن العالي) ، حيث يصعب فصل الكربيدات المتكونة عن المعدن. بدلاً من ذلك ، يتم اختزال رابع كلوريد الزركونيوم إلى معدن الزركونيوم في ما يسمى بعملية كرول مع المغنيسيوم في جو الهيليوم.

تُستخدم عملية Van Arkel de Boer للحصول على زركونيوم أنقى. أثناء التسخين تحت التفريغ ، يتفاعل الزركونيوم مبدئيًا مع اليود لتكوين يوديد الزركونيوم (IV). ينقسم هذا مرة أخرى إلى الزركونيوم واليود على سلك ساخن:

يتشكل رباعي يوديد الزركونيوم من الزركونيوم واليود عند 200 درجة مئوية ؛ يتفكك مرة أخرى عند 1300 درجة مئوية.
لا يمكن فصل الزركونيوم والهفنيوم بطريقة كيميائية بسيطة. لذلك ، حتى هذا الزركونيوم عالي النقاء لا يزال يحتوي على الهفنيوم. نظرًا لأنه من المهم بالنسبة للعديد من التطبيقات في تكنولوجيا المفاعلات أن الزركونيوم لم يعد يحتوي على الهافنيوم ، فإن عمليات فصل هذين المعدنين تلعب دورًا مهمًا. أحد الاحتمالات هو طرق الاستخراج التي يتم فيها استغلال قابلية الذوبان المختلفة لمركبات الزركونيوم والهفنيوم في المذيبات الخاصة. في كثير من الأحيان ، يتم استغلال الثيوسيانات وإمكانية ذوبانها المختلفة في كيتون إيزوبوتيل الميثيل. الاحتمالات الأخرى هي المبادلات الأيونية أو التقطير التجزيئي للمركبات المناسبة.
المواصفات
الخصائص الفيزيائية

هيكل الكريستال من الزركونيوم ألفا
الزركونيوم هو معدن ثقيل لامع فضي (الكثافة 6,501 جم / سم3 في 25 ° C) ، يشبه الصلب من الخارج. يتبلور المعدن في اثنين من التعديلات المختلفة التي يمكن تحويلها عن طريق تغيير درجة الحرارة. تحت 870 ° C يبلور α- الزركونيوم في نظام البلورة السداسية (تعبئة المجال السداسي الكثيف ، نوع المغنيسيوم) في المجموعة الفضائية 6/ mmm مع معلمات الشبكة a = 323 pm و c = 514 pm بالإضافة إلى وحدتي صيغة لكل خلية وحدة. في 870 ° C ، يتغير الهيكل البلوري إلى البنية ذات المحور المكعب (نوع التنغستن) مع المجموعة الفضائية  والمعلمة شعرية أ = 361 م.
والمعلمة شعرية أ = 361 م.
الزركونيوم ناعم ومرن نسبيًا. يمكن معالجتها بسهولة عن طريق التدوير والتزوير والدق. ومع ذلك ، يصبح هشًا وصعبًا بسبب انخفاض مستويات تلوث الهيدروجين أو الكربون أو النيتروجين في المعدن. الموصلية الكهربائية ليست جيدة مثل المعادن الأخرى. أنها ليست سوى حوالي 4 ٪ من النحاس. في المقابل ، الزركونيوم هو موصل جيد للحرارة. نقطة الانصهار ونقطة الغليان أعلى قليلاً بالمقارنة مع التيتانيوم المتماثل الأفتح (نقطة الانصهار: التيتانيوم: 1667 ° C ، الزركونيوم: 1857 ° C). أيضا ، الموصلية الكهربائية والحرارية هي أفضل. تحت 0,55 K ، يصبح الزركونيوم فائق التوصيل.
تتشابه خصائص الزركونيوم مع الهافنيوم المتماثل الثقيل جدًا بسبب انكماش اللانثانيد. وهذا يتطلب أنصاف أقطار ذرية متشابهة (Zr: 159 pm، Hf: 156 pm) وبالتالي خصائص مماثلة. يختلف المعدنان اختلافًا كبيرًا في كثافتهما (Zr: 6,5 جم / سم3، Hf: 13,3 جم / سم3).
من الخصائص المهمة ، التي اكتسب الزركونيوم بسببها أهمية كبيرة في بناء المفاعل ، المقطع العرضي الصغير لالتقاط النيوترونات. وبهذه السعة ، يختلف الزركونيوم أيضًا كثيرًا عن الهافنيوم. هذا يجعل عملية الفصل المعقدة ضرورية لهذه التطبيقات.
الخواص الكيميائية
الزركونيوم هو معدن أساسي يتفاعل مع العديد من غير المعادن ، خاصة في درجات الحرارة العالية. بشكل أساسي كمسحوق ، يحترق بلهب أبيض لتكوين ثاني أكسيد الزركونيوم ، في وجود النيتروجين أيضًا إلى نيتريد الزركونيوم وأكسينيتريد الزركونيوم. يتفاعل المعدن المضغوط فقط مع الأكسجين والنيتروجين عندما يكون لونه أبيض. عند زيادة الضغط ، يتفاعل الزركونيوم مع الأكسجين حتى في درجة حرارة الغرفة ، لأن أكسيد الزركونيوم المتكون قابل للذوبان في المعدن المنصهر.
يتم تخميل الزركونيوم في الهواء بواسطة طبقة رقيقة كثيفة جدًا من أكسيد الزركونيوم ، وبالتالي فهو خامل. لذلك فهو غير قابل للذوبان في جميع الأحماض تقريبًا ، فقط الماء الريجيا وحمض الهيدروفلوريك يهاجمان الزركونيوم في درجة حرارة الغرفة. لا تتفاعل القواعد المائية مع الزركونيوم.
النظائر
هناك العديد من نظائر الزركونيوم بينها 78Zr و 110Zr معروف. الزركونيوم الطبيعي هو عنصر مختلط يتكون من خمسة نظائر. هذه هي 90Zr ، والذي يحدث بشكل متكرر بحصة 51,45٪ من الزركونيوم الطبيعي ، بالإضافة إلى النظائر الثقيلة 91Zr (11,32٪) ، 92Zr (17,19٪) ، 94Zr (17,28٪) و 96Zr بنسبة 2,76٪. 96Zr هو النظير الطبيعي الوحيد ذو النشاط الإشعاعي الضعيف ، وهو يتحلل بعمر نصف يبلغ 24 · 1018 سنوات تحت اضمحلال بيتا المزدوج 96مو النظير 91يمكن الكشف عن Zr بمساعدة التحليل الطيفي بالرنين المغناطيسي النووي.
استعمال
 من أهم استخدامات الزركونيوم قذائف خلايا وقود اليورانيوم من زيركالوي في محطات الطاقة النووية. تتكون هذه السبيكة من زركونيوم 90٪ تقريبًا وكميات صغيرة من القصدير أو الحديد أو الكروم أو النيكل ، ولكن يجب ألا تحتوي على الهفنيوم. السبب في اختيار هذا العنصر هو المقطع العرضي المنخفض الموصوف بالفعل للنيوترونات الحرارية ذات المقاومة العالية للتآكل في وقت واحد ، مما يجعله مناسبًا أيضًا كمواد بناء للمصانع الكيماوية ، لا سيما بالنسبة لأجزاء الأجهزة الخاصة مثل الصمامات والمضخات والأنابيب والمبادلات الحرارية. كإضافة إلى صناعة السبائك الفولاذية ، فإنها تزيد أيضًا من مقاومة التآكل. يتم تصنيع الأدوات الجراحية من السبائك المناسبة.
من أهم استخدامات الزركونيوم قذائف خلايا وقود اليورانيوم من زيركالوي في محطات الطاقة النووية. تتكون هذه السبيكة من زركونيوم 90٪ تقريبًا وكميات صغيرة من القصدير أو الحديد أو الكروم أو النيكل ، ولكن يجب ألا تحتوي على الهفنيوم. السبب في اختيار هذا العنصر هو المقطع العرضي المنخفض الموصوف بالفعل للنيوترونات الحرارية ذات المقاومة العالية للتآكل في وقت واحد ، مما يجعله مناسبًا أيضًا كمواد بناء للمصانع الكيماوية ، لا سيما بالنسبة لأجزاء الأجهزة الخاصة مثل الصمامات والمضخات والأنابيب والمبادلات الحرارية. كإضافة إلى صناعة السبائك الفولاذية ، فإنها تزيد أيضًا من مقاومة التآكل. يتم تصنيع الأدوات الجراحية من السبائك المناسبة.
نظرًا لأن الزركونيوم يتفاعل مع كميات صغيرة من الأكسجين والنيتروجين ، فيمكن استخدامه كمادة جامدة في المصابيح المتوهجة وأنظمة التفريغ للحفاظ على الفراغ. تستخدم هذه الخاصية أيضًا في علم المعادن لإزالة الأكسجين والنيتروجين والكبريت من الفولاذ.
نظرًا لقدرته على إصدار ضوء ساطع جدًا عند الاحتراق ، فقد تم استخدامه بالإضافة إلى المغنيسيوم كمسحوق فلاش. على عكس المغنيسيوم ، يتمتع الزركونيوم بميزة عدم التدخين. يتم استغلال هذه الميزة أيضًا في الألعاب النارية وأضواء الإشارة.
يصدر الزركونيوم موجة من الشرر عندما يصطدم بالأسطح المعدنية ويكون قابل للاشتعال. يستخدم الجيش هذا في بعض أنواع الذخيرة مثل ذخيرة البندقية الخاصة Dragon's Breath والقنبلة الإنزلاقية الأمريكية AGM-154 JSOW متعددة الأغراض. في تكنولوجيا الأفلام ، يستخدم هذا التأثير للتأثيرات غير النارية ، على سبيل المثال ، الرصاص على الأسطح المعدنية.
سبائك الزركونيوم - النيوبيوم فائقة التوصيل وتظل كذلك حتى عند استخدام حقول مغناطيسية قوية. وبالتالي فهي تستخدم المغناطيس الفائق التوصيل.
بالإضافة إلى الشب المحتوي على الألومنيوم ، تستخدم أملاح الزركونيوم في "الدباغة البيضاء" للجلد.
سلامة
لا توجد آثار سامة معروفة للزركونيوم ومركباته. بسبب طبقة الأكسيد الكثيف ، الزركونيوم المضغوط غير قابل للاشتعال. في شكل مسحوق ، من ناحية أخرى ، قد تبدأ في الاحتراق عند تسخينها في الهواء. حرائق الزركونيوم خطيرة للغاية حيث لا يمكن استخدامها لإطفاء الماء (تفاعل قوي مع تكوين الهيدروجين) ، ولا ثاني أكسيد الكربون أو الهالون. يجب اخماد حرائق الزركونيوم بطفايات الحريق المعدنية (الفئة د) أو الرمال الجافة.
دليل
مع Alizarin Red-S ، يُشكل حمض الزركونيوم مركبًا أحمر بنفسجي مميز (البحيرة الملونة) ، والذي يختفي عند إضافة أيونات الفلوريد لتشكيل مجمع فلورو الزركونيوم. يمكن أن يكون هذا التفاعل بمثابة كشف نوعي لكل من الزركونيوم والفلور. نظرًا لأن كميات صغيرة من الفلوريد (والأنيونات الأخرى) تتداخل ، فإن هذا الاكتشاف غير مناسب للتحليل المعدني. بالإضافة إلى ذلك ، بعض المركبات العضوية الأخرى ، مثل التانين ، كوبفرون ، حمض فينيلارسونيك ، أوكسين أو زيلينول برتقالي ، مناسبة لكاشف للكشف. مركب مميز آخر هو كلوريد الزركونيوم ZrOCl2 8 H2يا ، والتي تتبلور في الإبر النموذجية. في التحليل الحديث ، يمكن اكتشاف الزركونيوم بواسطة مطياف الامتصاص الذري (AAS) أو قياس الطيف الكتلي (أيضًا بواسطة نمط النظير).
أحد الاحتمالات للتحليل الكمي هو هطول هيدروكسيد الزركونيوم القابل للذوبان قليلًا مع الأمونيا والتكلس اللاحق إلى الزركونيا.

- هطول هيدروكسيد
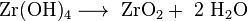
- نقل إلى العفن وزنها
روابط
كمعدن أساسي ، يشكل الزركونيوم العديد من المركبات. معظم مركبات الزركونيوم هي أملاح. غالبًا ما تكون مستقرة جدًا ولها نقطة انصهار عالية. تفضل حالة الأكسدة + IV والأكثر استقرارًا. ومع ذلك ، توجد أيضًا مركبات في حالات الأكسدة + III إلى + I ، وفي حالة المجمعات حتى في الحالات 0 و I و −II.
زركونيا
 أهم مركبات الزركونيوم هو ثاني أكسيد الزركونيوم ZrO2، وهو أكسيد مستقرة جدا والحرارية. يستخدم ثاني أكسيد الزركونيوم لإنتاج بطانات حرارية في البوتقات والأفران. من أجل استخدامه ، يجب أن يستقر مع الكالسيوم أو الإيتريا أو المغنيسيا لتحقيق الاستقرار في مرحلة ارتفاع درجة الحرارة مكعب. بالإضافة إلى ذلك ، يتم استخدامه كمادة كاشطة وبسبب اللون الأبيض كصباغ أبيض للخزف.
أهم مركبات الزركونيوم هو ثاني أكسيد الزركونيوم ZrO2، وهو أكسيد مستقرة جدا والحرارية. يستخدم ثاني أكسيد الزركونيوم لإنتاج بطانات حرارية في البوتقات والأفران. من أجل استخدامه ، يجب أن يستقر مع الكالسيوم أو الإيتريا أو المغنيسيا لتحقيق الاستقرار في مرحلة ارتفاع درجة الحرارة مكعب. بالإضافة إلى ذلك ، يتم استخدامه كمادة كاشطة وبسبب اللون الأبيض كصباغ أبيض للخزف.
بلورات ثاني أكسيد الزركونيوم عديمة اللون ولها معامل انكسار عالٍ. هذا هو السبب في أنها معروفة باسم الزركونيا كأحجار كريمة اصطناعية وبديل للماس.
إذا تم خلط أكسيد الزركونيوم مع أكسيد الإيتريوم ، تظهر إمكانيات إضافية للتطبيق. عند نسبة ثلاثة في المائة من محتوى أكسيد الإيتريوم ، يكون ZrO2 استقرت في بنية فلوريت مشوهة. نتيجة لذلك ، يعمل كقائد لأيونات الأكسجين في درجات حرارة أعلى من 300 ° C. تطبيق مهم لهذا هو مسبار Lambda في السيارات ، والذي يستخدم لقياس محتوى الأكسجين في غازات العادم للمحفز. في محتوى 15٪ yttria ، تصدر الزركونيا ضوءًا ساطعًا أبيض على 1000 ° C. يستخدم هذا في تطبيق مصباح Nernst المزعوم. نظرًا لأن سيراميك الإيتريوم - الزركونيوم لديه صلابة عالية للغاية في الكسر ، يتم استخدامه ، على سبيل المثال ، في طب الأسنان كإطار تاج وجسر مستقر للغاية ، في مفاصل الورك الاصطناعية وزراعة الأسنان أو كعنصر وصل في التلسكوبات. في هذه العملية ، تحل بشكل متزايد محل الذهب والمعادن الأخرى في وظيفتها.
غالبًا ما يستخدم الزركونيا أيضًا في محامل الكرات. خاصة بالنسبة لسباقات المحامل ، ZrO2 الميزة العظيمة هي أن معامل التمدد الحراري قريب من معامل التمدد الحراري. عادةً ما يكون للسيراميك التقني الآخر مثل نيتريد السيليكون معامل تمدد حراري أقل بكثير.
هاليدات
مع الهالوجينات الفلور والكلور والبروم واليود ، يشكل الزركونيوم عدة سلاسل من المركبات. جميع الهالوجينات هي مركبات من شكل ZrX4، ZrX3 و ZrX2 معروف. بالإضافة إلى ذلك توجد الكلوريدات والبروميدات واليوديد من شكل ZrX. رباعي الهاليد من النموذج ZrX هي الأكثر استقرارًا4، لا يُعرف أن لأي من هاليدات الزركونيوم تطبيقات مهمة ، حيث يتم استخدام كلوريد الزركونيوم كوسيط في تحضير الزركونيوم النقي.
مزيد من مركبات الزركونيوم
سيليكات الزركونيوم، ZrSiO4، المعروف تحت الاسم المعدني الزركون ، هو مركب الزركونيوم الأكثر شيوعًا الموجود في الطبيعة. وهو أهم مصدر للزركونيوم ومركباته ، كما يستخدم الزركون كأحجار كريمة.
تكون مركبات الزركونيوم العضوية في الغالب غير مستقرة. مجمعات الزركونيوم العضوية ، ما يسمى. zirconocenes، مع الجذور مثل cyclopentadienyl. إنها مهمة تقنياً كعامل مساعد في بلمرة الألكينات ، خاصةً لإنتاج مادة البولي بروبيلين. تطبيق آخر لمركب الزركونيوم العضوي في hydrozirconation، هذه الألكينات تستخدم كاشف شوارتز Cp2ZrHCl (Cp = سيكلوبنادينيل) يتم تحويله إلى كحول أو هيدروكربونات مهلجنة. في تفاعل الألكينات الطرفية مع كاشف شوارتز ينشأ في الروابط المزدوجة المهدورة بالهيدروجين ، يؤدي التفاعل الإضافي مع الكاشف الكهربي إلى ألكينات متعددة الوظائف في نقاوة كيميائية مجسمة عالية.
يمكن استخدام مجمعات الألمنيوم والزركونيوم كمضاد للعرق.
البوتاسيوم hexafluoridozirconate (الرابع) ك2ZRF6 (CAS: 16923-95-8) يمكن استخدامها لفصل الزركونيوم عن الهافنيوم.
توجد كربونات الزركونيوم كمركب أساسي. يتم استخدامه ، من بين أمور أخرى ، في صناعة الورق.
| عموما | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| الاسم والرمز والرقم الذري | الزركونيوم ، Zr ، 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سلسلة | الفلزات الإنتقالية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة ، الفترة ، الكتلة | 4 ، 5 ، د | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مظهر | أبيض فضي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد CAS | 7440-67-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جزء من كتلة الأرض قذيفة | 0,021٪ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نووي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 91,224 ش | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف القطر الذري (محسوب) | 155 (206) مساءً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر التساهمية | 148 PM | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | [كر] 4d2 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. التأين | 640,1 كيلو جول / مول | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. التأين | 1270 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. التأين | 2218 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. التأين | 3313 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بدنيا | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الحالة الفيزيائية | مهرجان | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التعديلات | اثنان (α- / β-Zr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التركيب البلوري | سداسية ؛ مكعب> 1140 كلفن (867 درجة مئوية) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة | شنومكس ز / سم3 (25 درجة مئوية) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلابة موس | 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مغنطيسية | بارامغناطيسية ( = 1,1 10-4) = 1,1 10-4) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| درجة الإنصهار | 2130 كلفن (1857 درجة مئوية) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 4682 كلفن (4409 درجة مئوية) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حجم المولي | 14,02 · 10-6 m3/ مول | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 590,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 16,9 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | 0,00168 باسكال عند 2125 ك. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت | 4650 (طويلة.) ، 2250 (trans.) M / s في 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| قدرة حرارة محددة | 270,0 J / (كجم · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الموصلية الكهربائية | 2,36 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توصيل حراري | 22,7 واط / (م · ك) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كيميائي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التأكسد | يناير ٢٠٢٤ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| إمكانات طبيعية | −1,553 فولت (ZrO2 + 4 هـ.+ + 4 هـ- → Zr + 2 H.2O) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهربية | 1,33 (مقياس بولينج) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خصائص NMR | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سلامة | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
أسعار الزركونيوم
سعر الزركونيوم -> أسعار المعادن الإستراتيجية


