الجرمانيوم ، قه ، العدد الذري 32
سعر الجرمانيوم ، حدوث ، استخراج ، استخدام
الجرمانيوم (من الجرمانية اللاتينية "ألمانيا" ، بعد البلد الذي عثر عليها لأول مرة) هو عنصر كيميائي مع رمز العنصر Ge والرقم الذري 32. في الجدول الدوري يكون في 4. الفترة وفي 4. المجموعة الرئيسية (14 ، IUPAC group ، p-block and carbon group). كان على 6. تم الكشف عن 1886 لشهر فبراير في أرجيريت المعادن
قصة
عندما صمم Xnumx Dmitri Mendeleev الجدول الدوري ، اكتشف فجوة أسفل السيليكون وافترض عنصرًا غير معروف حتى الآن ، أطلق عليه اسم Eka silicon. قام منديليف بعمل تنبؤات حول خواص Eka-silicon ومركباته التي رفضها العلم.
وجد 1885 كليمنس وينكلر (1838-1904) ، الكيميائي في Bergakademie Freiberg ، عندما كان يعمل مع argyrodite المعدنية المكتشفة حديثًا ، أن تحليله الكمي أدى دائمًا إلى عجز يبلغ حوالي سبعة بالمائة. وبقدر ما يتكرر التحليل ، ظل النقص ثابتًا تقريبًا ، وفي النهاية خمن وينكلر أن المعدن يحتوي على عنصر غير معروف حتى الآن. بعد أربعة أشهر من العمل ، نجح أخيرًا في 6. فبراير 1886 عزل من كبريتيد أبيض يترسب ، والتي يمكن أن تخفض في تيار الهيدروجين إلى مسحوق معدني. بعد الكوكب المكتشف مسبقًا نبتون ، أراد وينكلر في البداية استدعاء العنصر الجديد نبتون. نظرًا لأن هذا الاسم قد تم استخدامه بالفعل لعنصر مشتبه به آخر ، فقد أطلق عليه اسم اكتشاف الجرمانيوم. اقترح وينكلر أولاً أن الجرمانيوم كان ستيب إيكا الذي افترضه مينديليف ، بينما أراد مينديليف في البداية أن يصنفه ككادميوم إيكا بدلاً من سُيل إيكا. بعد تحديد خصائص أخرى ، تم التأكيد على أنه ربما كان العنصر المتوقع Eka-silicon. كان Mendeleev قد استمد خصائصه من جدوله الدوري ، بحيث ساهم هذا الاكتشاف في التعرف على الجدول الدوري:
يمكن أن ينشأ أصل مصطلح الجرمانيوم ولسانيته أيضًا عن سوء فهم دلالي فيما يتعلق بعنصر سلفه غاليوم ، نظرًا لوجود نظريتين لتسمية الغاليوم. بعد الأول ، قام الكيميائي الفرنسي بول إميل ليكوك دي بواسبودران بتسمية العنصر باسم الغال ، الاسم اللاتيني لوطنه الأصلي فرنسا. والثاني هو أيضًا الكلمة اللاتينية جالوس (الديك) كمصدر للاسم ، مما يعني le coq ("الديك") باللغة الفرنسية. كان بول إميل ليكوك دي بواسبودران قد سمى العنصر الجديد باسمه. افترض وينكلر أن العنصر السابق غاليوم كان يحمل اسم جنسية المستكشف الفرنسي. لذلك أطلق على العنصر الكيميائي الجديد اسم "الجرمانيوم" تكريماً لبلده (جيرمانيا اللاتينية لألمانيا).
ظهور
الجرمانيوم واسع الانتشار ولكنه لا يحدث إلا بتركيزات منخفضة للغاية ؛ قيمة كلارك (= متوسط المحتوى في قشرة الأرض): 1,5 g / t. في الطبيعة ، عادة ما يحدث كبريتيد (ثيوجرمانيت) وغالبًا ما يتم العثور عليه كمرافق في خامات النحاس والزنك (صخر النحاس من مانسفيلد). المعادن الأكثر أهمية هي أرجيريت 

استخراج والإنتاج
وفقًا لوكالة المسح الجيولوجي الأمريكية ، قدر الإنتاج السنوي لـ 2014 بـ 165 t ، منها 120 t في الصين. سعر 1 kg الجرمانيوم كان 2014 حول 1.900 USD. وفقًا للاتحاد الأوروبي ، كان سعر 2003 هو 300 USD / kg ، وارتفع إلى 2009 USD بواسطة 1.000.
لتمثيل الجرمانيوم ، خاصة غازات المداخن (تحتوي على أكسيد الجانيوم) 

المواصفات
الجرمانيوم الأولي
توجد الجرمانيوم في الجدول الدوري في سلسلة شبه المعادن ، ولكن يتم تصنيفه حسب التعريف الحديث على أنه أشباه الموصلات. الجرمانيوم الأولي هش للغاية ومستقر للغاية في الهواء في درجة حرارة الغرفة. يتأكسد إلى أكسيد الجرمانيوم (الرابع) (GeO2) فقط بعد الصلب القوي في جو الأكسجين. GeO2 غير ثنائي الشكل ويتم تحويله عند 1033 ° C عن طريق تعديل الروتيل (CN = 6) في هيكل الكوارتز ß (CN = 4). في شكل مسحوق ، إنها مادة صلبة قابلة للاشتعال ويمكن بسهولة إشعالها عن طريق التعرض لفترة وجيزة لمصدر الإشعال وتستمر في الاحتراق بعد الإزالة. خطر الاشتعال أكبر ، يتم توزيع أدق المادة. في شكل مضغوط ، فإنه غير قابل للاشتعال. الجرمانيوم ثنائي التكافؤ ورباعي التكافؤ. الجرمانيوم (الرابع) المركبات هي الأكثر استقرارا. من حمض الهيدروكلوريك ، لا يتم مهاجمة محلول هيدروكسيد البوتاسيوم والجرمانيوم المخفف لحامض الكبريتيك. في محاليل بيروكسيد الهيدروجين القلوية ، وحمض الكبريتيك الساخن المركز وحامض النيتريك المركز ، يذوب في تكوين هيدرات ثاني أكسيد الجرمانيوم. حسب موقعه في الجدول الدوري ، فإن خواصه الكيميائية بين السيليكون والقصدير.
الجرمانيوم هو واحد من المواد القليلة التي لها خاصية شذوذ الكثافة. كثافته أقل في الحالة الصلبة من الحالة السائلة. فجوة شريطها تدور حول 0,67 eV في درجة حرارة الغرفة.
رقائق الجرمانيوم أكثر هشاشة بكثير من رقائق السيليكون.
استعمال
إلكترونيات
بصفتها أشباه الموصلات ، كانت الجرمانيوم في شكل بلوري واحد المادة الرائدة في مركز الإلكترونيات في 20. خاصة لإنتاج الثنائيات الجرمانيوم الأولى والترانزستورات ثنائية القطب المتاحة في السوق حتى تم استبداله بواسطة السيليكون في هذه المناطق. اليوم ، تم العثور على التطبيقات في تقنية عالية التردد (على سبيل المثال ، أشباه الموصلات مجمع الجرمانيوم السيليكون) وتكنولوجيا الكاشف (على سبيل المثال كاشف الأشعة السينية). تصنع خلايا شمسية من زرنيخيد الغاليوم (GaAs) أحيانًا من رقائق الجرمانيوم. يشبه ثابت شبكة الجرمانيوم الشبيه بشبكة الجرمانيوم شبيها بما في ذلك زرنيخيد الغاليوم ، بحيث ينمو GaAs فوق البلورات الجرمانيوم المفردة.
النظارات والألياف
تطبيقه الرئيسي الثاني هو في مجال البصريات بالأشعة تحت الحمراء في شكل أنظمة النوافذ والعدسات المصنوعة من الجرمانيوم متعدد الكريستالات أو أحادي البلورية والنظارات البصرية مع نفاذية الأشعة تحت الحمراء ، ما يسمى نظارات كالكوجينيد. وتشمل التطبيقات أجهزة الرؤية الليلية العسكرية والمدنية وكذلك كاميرات التصوير الحراري.
الاستخدامات الرئيسية الأخرى هي في إنتاج الألياف البصرية وألياف البوليستر: في الألياف الزجاجية الحديثة للاتصالات ، يستخدم رابع كلوريد الجرمانيوم في ترسيب البخار الكيميائي لتوليد ثاني أكسيد الجرمانيوم في اللب الداخلي للألياف. وهذا يؤدي إلى ارتفاع معامل الانكسار في القلب مقارنةً بتكسية الألياف ، حيث يتم ضمان توجيه الموجات الضوئية. في كيمياء البوليستر ، يستخدم ثاني أكسيد الجرمانيوم كعامل مساعد في إنتاج ألياف وحبيبات بوليستر معينة ، خاصة لزجاجات PET القابلة لإعادة التدوير (PET = polyethylene terephthalate).
الطب النووي والتكنولوجيا النووية
يستخدم 68Ge في مولد Gallium 68 كوكلاء نووي أصل لإنتاج Gallium-68. وبالمثل ، يستخدم 68Ge كمصدر لمعايرة الكاشف في التصوير المقطعي بالإصدار البوزيتروني.
كما يستخدم الجرمانيوم وضوح الشمس عالية النقاء واحدة للكشف عن الإشعاع.
الجرمانيوم في المكملات الغذائية
تم وصف مادة Bi (carboxyethyl) gesiumium sesquioxide (Ge-132) كمكمل غذائي للاستخدام في عدد من الأمراض بما في ذلك السرطان ومتلازمة التعب المزمن ونقص المناعة والإيدز وارتفاع ضغط الدم والتهاب المفاصل والحساسية الغذائية. الآثار الإيجابية على مسار المرض لم تثبت علميا بعد.
وفقًا للتوجيه الأوروبي 2002 / 46 / EC بشأن تقريب قوانين الدول الأعضاء فيما يتعلق بالمكملات الغذائية ، يجب عدم استخدام الجرمانيوم في المكملات الغذائية. في العديد من دول الاتحاد الأوروبي التي نسقت بالفعل تشريعاتها الوطنية ، بما في ذلك ألمانيا والنمسا ، لا يُسمح بإضافة الجرمانيوم كمصدر للمعادن في المكملات الغذائية.
تحذر السلطات المختصة صراحة من استهلاك Ge-132 ، حيث لا يمكن استبعاد الآثار الصحية الخطيرة والوفيات.
الاستخدام الطبي للجرمانيوم
لم يتم إثبات الفعالية العلاجية للمادة المضادة للبلاستيك spirogermanium في السرطان. لا توجد منتجات طبية نهائية معتمدة مع العنصر النشط spirogermanium. في ألمانيا ، تعتبر المستحضرات الصيدلانية المحتوية على الجرمانيوم (المستحضرات) ، بصرف النظر عن التخفيفات المثلية من D4 ، محل شك. وبالتالي يحظر إنتاجها وتسليمها. الجرمانيوم ميتاليكوم متاح في شكل أدوية المعالجة المثلية. كجزء من الاستعدادات المثلية يوصف اللاكتات السترات البوتاسيوم الجرثوميوم.
علم وظائف الأعضاء
الجرمانيوم ومركباته لها سمية منخفضة نسبيا. يتم تضمين آثار الجرمانيوم في الأطعمة التالية: الفول وعصير الطماطم والمحار والتونة والثوم. ليس عنصر تتبع أساسيًا وفقًا لحالة الفن. لا توجد وظيفة بيولوجية معروفة للجرمانيوم. وقد تمت مناقشة تأثير محتمل على التمثيل الغذائي للكربوهيدرات. لا توجد أمراض نقص الجرمانيوم المعروفة.
سمية
في الماضي ، لم يحدث التسمم بالجرمانيوم في البشر إلا بعد تناول مركبات الجرمانيوم غير العضوية كمكمل غذائي. الأعراض الأولى هي فقدان الشهية ، وفقدان الوزن ، والتعب وضعف العضلات. ويتبع ذلك عطل في الكلى ، يصل إلى الفشل الكلوي ، والتي يمكن أن تكون قاتلة للمريض. تم الإبلاغ عن الاعتلال العصبي المحيطي نتيجة للمرض.
تم الإبلاغ عن الآثار الجانبية السمية العصبية المؤقتة عند تناول spirogermanium في التجارب السريرية. تم اختبار Spiro-germanium كعامل تثبيط الخلايا في سنوات 1980. بيانات الدراسات على المتطوعين الأصحاء غير متوفرة.
من التجارب على الحيوانات فمن المعروف أن الجرمانيوم لديه سمية الفم الحادة منخفضة. تشمل أعراض التسمم الحاد بجرعات كبيرة من مركبات الجرمانيوم ما يلي:
- تمدد الأوعية الدموية (الارتقاء)
- إطراق
- الازرقاق
- هزة أرضية
أخيرًا ، يؤدي شلل الجهاز التنفسي إلى موت الحيوانات التجريبية. أعراض التسمم المزمن أو شبه المزمن بمركبات الجرمانيوم غير العضوية هي:
- Gewichtsverlust
- تغييرات الأعضاء (كتلة الأعضاء)
- الاعتلال العصبي التدريجي
- الفشل الكلوي
أظهرت مركبات الجرمانيوم العضوية سمية أقل ، ولكنها أسفرت عن حيوانات تجريبية لفقدان الوزن وانخفاض في عدد خلايا الدم الحمراء. لا يوجد سوى بيانات محدودة عن الآثار المسخية للجرمانيوم. تم اختبار جرمانيت الصوديوم في فئران غير مسرطنة.
آلية سمية الجرمانيوم ليست مفهومة تماما بعد. ومع ذلك ، فقد لوحظت آثار مرضية محددة على الميتوكوندريا في خلايا الكلى والأعصاب.
التفاعلات
وتناقش أيضًا ما إذا كان الجرمانيوم قد يظهر تفاعلات مع السيليكون في استقلاب العظام. يمكن أن يمنع عمل مدرات البول ويقلل نشاط عدد من الإنزيمات ، مثل هيدروجينازيس. في التجارب على الحيوانات ، أظهرت الفئران زيادة مدة النوم الناجمة عن سداسي البروم عند علاجها بالإضافة إلى مركبات الجرمانيوم. هذا يشير إلى أن نشاط السيتوكروم P450 مقيد أيضًا. هناك تقارير عن مركبات الجرمانيوم العضوية التي تمنع انزيم إزالة السموم الجلوتاثيون- S- الترانسفيز.
التوافر البيولوجي والتمثيل الغذائي
يمتص الجسم بسهولة الجرمانيوم عند تناوله. يتم توزيعه على أنسجة الجسم بأكملها ، وخاصة في الكلى والغدة الدرقية. على عكس مركبات الجرمانيوم غير العضوية ، لا تتراكم الكائنات العضوية في جسم الإنسان. ومع ذلك ، لا يوجد سوى عدد قليل من الدراسات حول استقلاب الجرمانيوم.
تفرز أساسا في البول. إفراز عبر الصفراء والبراز يحدث أيضا.
روابط
الجرمانيوم أشكال قه (الثاني) - ش. مركبات Ge (IV) أكثر ثباتًا ، قليل منها له أهمية تقنية.
من هاليدات الجرمانيوم هي أيضا قه (الثاني) - ش. قه (الرابع) ممثل معروف. تتشكل رباعي كلوريد الجرمانيوم ، (GeCl4) ، وهو سائل ذو درجة غليان 83 ° C ، عند التعرض لكلوريد الهيدروجين إلى أكاسيد الجرمانيوم وهو وسيط مهم في استرداد الجرمانيوم. درجة نقاء عالية تستخدم GeCl4 في صناعة الألياف الضوئية المصنوعة من زجاج الكوارتز لإنتاج طبقة أكسيد جرمانيوم (IV) عالية النقاء من داخل ألياف الكوارتز. لإنتاج طبقات جرمانيوم عالية النقاء ، من الممكن أيضًا استخدام عدم التناسب من جرمانيوم (II) يوديد لتشكيل الجرمانيوم واليود الجرمانيوم (IV):
الألمانات هي مركبات الجرمانيوم المستمدة من أكسيدها. في معظم المعادن التي تحتوي على الجرمانيوم ، يوجد الجرمانيوم كجرمانيوم.
يطلق على الألمان مركبات الهيدروجين الخاصة بالجرمانيوم ، والتي تشكل سلسلة متجانسة من جزيئات السلسلة الطويلة المختلفة. إن أحادي الهيرمان أو هيدريد الجرمانيوم (GeH4) هو غاز يستخدم في صناعة أشباه الموصلات من أجل الفصقة والمنشطات.
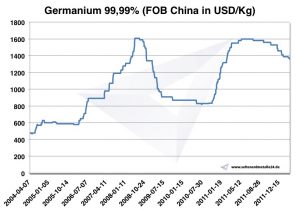
الرسم البياني الجرمانيوم 2004-2011

